प्रतिरक्षण विरासत में मिला है। जन्मजात प्रतिरक्षा क्या है - तंत्र और प्रकार। जन्मजात प्रतिरक्षा के कारक
प्रतिरक्षा बढ़ाता है मनुष्यों को कई पशु रोग।
आनुवंशिक प्रतिरक्षाकुछ संक्रामक रोगों के लिए एक व्यक्ति (माता-पिता से विरासत में मिला);
जैविक सुरक्षा
- uPF प्रतियोगिता (सशर्त रूप से रोगजनक माइक्रोफ्लोरा) शरीर का प्राकृतिक माइक्रोफ्लोरा एक व्यक्ति की त्वचा और श्लेष्म झिल्ली पर रोगजनक सूक्ष्मजीवों के साथ प्रतिस्पर्धा करता है और उन्हें त्वचा और श्लेष्म झिल्ली का उपनिवेशण करने की अनुमति नहीं देता है;
- उपकला का अवतरण (एक साथ desquamated उपकला के साथ, त्वचा और श्लेष्म झिल्ली को अतिरिक्त सूक्ष्मजीवों से मुक्त किया जाता है);
- रासायनिक सुरक्षा त्वचा और श्लेष्मा झिल्ली (वसामय और त्वचा की पसीने की ग्रंथियां, पेट के हाइड्रोक्लोरिक एसिड, और श्लेष्म झिल्ली के अन्य रहस्य ऐसे पदार्थों का स्राव करते हैं जिनमें जीवाणुनाशक प्रभाव होता है)।
एक्वायर्ड इम्यूनिटी - जीवन भर बनता है, और विरासत में नहीं मिलता है।
- यह एक बीमारी के बाद बनता है, यह एक अव्यक्त बीमारी या छोटी खुराक (घरेलू टीकाकरण) में कई संक्रमणों के परिणामस्वरूप बन सकता है।
प्राकृतिक सक्रिय प्रतिरक्षा
अंतर्गर्भाशयी बीमारी की अवधि के दौरान और स्तनपान के दौरान मां की नाल के माध्यम से प्राप्त नवजात शिशुओं की प्रतिरक्षा। यह प्रतिरक्षा 6-8 महीने की उम्र तक गायब हो जाती है।
कृत्रिम सक्रिय प्रतिरक्षा -एक व्यक्ति टीके की शुरूआत के परिणामस्वरूप प्राप्त करता है। यह प्रतिरक्षा बैक्टीरिया के शरीर में शुरू होने के बाद विकसित होती है, उनके जहर, वायरस कमजोर या विभिन्न तरीकों से मारे जाते हैं। इस मामले में, शरीर का एक सक्रिय पुनर्गठन होता है, जिसका उद्देश्य उन पदार्थों के निर्माण के लिए होता है जो रोगज़नक़ और इसके विषाक्त पदार्थों पर हानिकारक प्रभाव डालते हैं। (एंटीबॉडी) । ऐसी प्रतिरक्षा का विकास 3-4 सप्ताह होता है, और यह 1 वर्ष से 3-5 साल तक रहता है। यह टीकों का उपयोग करके बनाया गया है।
कृत्रिम निष्क्रिय प्रतिरक्षा -इसका गठन तब किया जाता है जब तैयार एंटीबॉडी को सीरम और इम्युनोग्लोबुलिन में निहित शरीर में पेश किया जाता है। ऐसी प्रतिरक्षा प्रशासन के तुरंत बाद बनाई जाती है और 15-20 दिनों तक रहती है।
प्रतिरक्षा रक्षा का प्रतिनिधित्व विशिष्ट द्वारा किया जाता है (यानी, एक विशिष्ट, / g के लिए निर्देशित) और गैर-विशिष्ट (किसी भी / g के लिए निर्देशित) कारक।
प्रतिरक्षा humoral(एंटीबॉडी और प्रोटीन के कारण (इंटरफेरॉन, इंटरल्यूकिन, पूरक, आदि)
सेलुलर(फागोसाइट्स के कारण, टी-लिम्फोसाइट्स, एनके कोशिकाएं)
गैर-विशिष्ट प्रतिरोध कारक (प्रतिरक्षा रक्षा) में शामिल हैं:
· जैविक सुरक्षा (ऊपर देखें)
सेल्युलर डिफेंस को फागोसाइट्स और टी-लिम्फोसाइट्स द्वारा दर्शाया जाता है
· रक्त के प्रोटीन द्वारा हास्य संरक्षण का प्रतिनिधित्व किया जाता है: प्रशंसा, इंटरफेरॉन, ऑप्सिन, उचित, तीव्र चरण प्रोटीन; लाइसोजाइम, आदि।
विशिष्ट कारकों में शामिल हैं:
एंटीबॉडी का गठन
विलंबित अतिसंवेदनशीलता (HRT)
तत्काल प्रकार की अतिसंवेदनशीलता (GNT)
इम्यूनोलॉजिकल मेमोरी
· प्रतिरक्षात्मक सहिष्णुता
निरर्थक प्रतिरक्षा रक्षा के सेलुलर कारक
फ़ैगोसाइट
पहली बार फागोसाइटोसिस की घटनाओं पर विचार किया गया और आई.आई. मेचनिकोव के फागोसाइट्स में विभाजित किया गया:
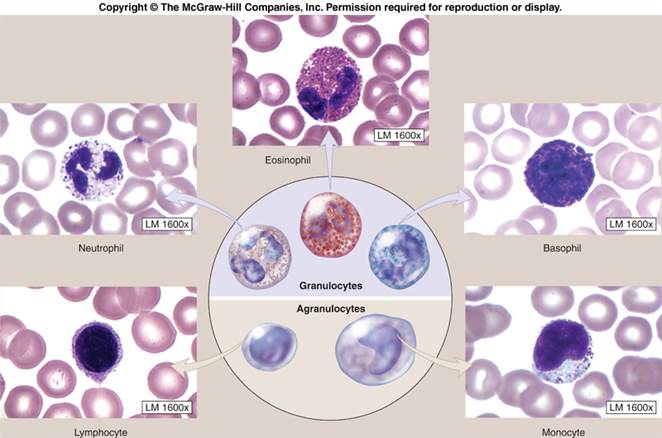
1. मैक्रोफेज (PMNM बहुरूपी - नाभिकीय ल्यूकोसाइट्स) - उनके अनियमित आकार के नाभिक और दानों में बड़ी संख्या में एंजाइम होते हैं। इनमें शामिल हैं: न्यूट्रोफिल, ईोसिनोफिल, बेसोफिल। रोमनोव्स्की धुंधला के दौरान उनके रूपात्मक मतभेदों का पता चला था। न्युट्रोफिल को अम्लीय डाई ईोसिन और मुख्य रंजक दोनों के साथ सना हुआ है, केवल ईओसिन के साथ दाग वाले ईोसिनोफिल के विपरीत और केवल मुख्य रंजक के साथ दाग वाले बेसिन से।
न्यूट्रोफिलये गैर-विभाजित और अल्पकालिक कोशिकाएं हैं। सभी सफेद रक्त कोशिकाओं के 95% की रचना करें। उनका कार्य विदेशी कणों का विनाश (फैगोसाइटोसिस) है, जिसमें बैक्टीरिया और कवक शामिल हैं। फागोसाइटोसिस के बाद, न्यूट्रोफिल आमतौर पर मर जाते हैं, बैक्टीरिया और कवक को नुकसान पहुंचाने वाले जैविक रूप से सक्रिय पदार्थों की एक बड़ी संख्या को जारी करते हैं, जो प्रतिरक्षा कोशिकाओं की सूजन और कीमोटैक्सिस (आकर्षण) को बढ़ाते हैं। रोगाणुओं को नुकसान न्युट्रोफिल ग्रैन्यूल की मदद से होता है जिसमें निम्न हैं: लाइसोजाइम, लिपोपरोक्सीडेज, मायलोपरोक्सीडेज।
न्यूट्रोफिल एंटीजन के स्थान पर स्वतंत्र रूप से प्रवास करने में सक्षम होते हैं, क्योंकि उनके पास केमोटैक्सिस रिसेप्टर्स (एक रासायनिक पदार्थ के लिए एक मोटर प्रतिक्रिया) है। न्यूट्रोफिल संवहनी एंडोथेलियम को "छड़ी" करने में सक्षम हैं और फिर दीवार के माध्यम से एंटीजन के स्थान पर पलायन करते हैं। फिर फागोसाइटोसिस गुजरता है, और न्यूट्रोफिल धीरे-धीरे चयापचय उत्पादों से भर जाते हैं। फिर वे मर जाते हैं और मवाद में बदल जाते हैं।
बैक्टीरियल और फंगल संक्रमण के खिलाफ शरीर की रक्षा करने में वायरल संक्रमणों से बचाने में अपेक्षाकृत कम भूमिका में न्युट्रोफिल बहुत महत्वपूर्ण भूमिका निभाते हैं। एंटीट्यूमोर या एंटीहेल्मिक संरक्षण में, न्युट्रोफिल व्यावहारिक रूप से एक भूमिका नहीं निभाते हैं। पर पुरानी सूजन और संक्रमण, न्यूट्रोफिल की भूमिका नगण्य है, और लिम्फोसाइट्स प्रबल होते हैं।
न्यूट्रोफिल टी-लिम्फोसाइटों के एंटीबॉडी के उत्पादन के लिए एक आवेग संचारित करने में सक्षम नहीं हैं, केवल मोनोसाइट्स और मैक्रोफेज इसके लिए सक्षम हैं।
basophils - ग्रैन्यूलोसाइट्स में बड़ी मात्रा में हिस्टामाइन, सेरोटोनिन, ल्यूकोट्रिनेस, प्रोस्टाग्लैंडीन और एलर्जी और सूजन के अन्य मध्यस्थ होते हैं, जो कोशिकाओं से जारी होते हैं, इन मध्यस्थों के कारण एक चिकनी मांसपेशियों में संकुचन होता है और एक एलर्जी प्रतिक्रिया होती है।
तत्काल प्रकार की एलर्जी प्रतिक्रियाओं के विकास में सक्रिय रूप से बासोफिल शामिल हैं। एक बार ऊतकों में, बेसोफिल्स मस्तूल कोशिकाओं में बदल जाते हैं, जिसमें बड़ी मात्रा में हिस्टामाइन होता है, जो जैविक रूप से सक्रिय पदार्थ है जो एलर्जी के विकास को उत्तेजित करता है। बेसोफिल हेपरिन के साथ रक्त जमावट को नियंत्रित करता है। ऊतकों में बेसोफिल मस्तूल कोशिकाएँ इम्युनोग्लोबुलिन ई (IgE) सतह पर किया जाता है। बेसोफिल्स में केमोटैक्सिस और फागोसाइटोसिस की क्षमता है, लेकिन उनकी संख्या बड़ी नहीं है।
इयोस्नोफिल्ससक्रिय अमीबॉइड आंदोलन में सक्षम, रक्त वाहिकाओं की दीवारों से परे पैठ और केमोटैक्सिस (सूजन या ऊतक क्षति के फोकस की दिशा में प्रमुख आंदोलन)। फेगोसाइटोसिस में सक्षम। इओसिनोफिल्स हिस्टामाइन को अवशोषित और बाँधने में सक्षम हैं और एलर्जी और सूजन के कई अन्य मध्यस्थों, अर्थात्। एंजाइमों को ले जाएं जो बेसोफिल मध्यस्थों और मस्तूल कोशिकाओं के हानिकारक प्रभावों को बेअसर करते हैं। रक्त में ईोसिनोफिल का प्रतिशत एलर्जी की स्थिति और कुछ हेलमनिथेसिस के साथ बढ़ता है।
2. मैक्रोफेज अस्थि मज्जा से शुरू, promonocyte (लाल अस्थि मज्जा में) monocytes (खून में)।
मोनोसाइट्स में बदल जाता है मैक्रोफेज प्लीहा में। मैक्रोफेज दो प्रकार के होते हैं:
1. पेशेवर मैक्रोफेज। उनका मुख्य कार्य माइक्रोबियल संक्रमण के खिलाफ फैगोसाइटिक सुरक्षा प्रदान करना है। वे क्षतिग्रस्त शरीर की कोशिकाओं को रक्त कोशिकाओं सहित phagocytize करने में सक्षम हैं। मैक्रोफेज साइटोकिन्स को स्रावित करते हैं जो एंटीफंगल को न्यूट्रोफिल और ईोसिनोफिल को आकर्षित करते हैं।
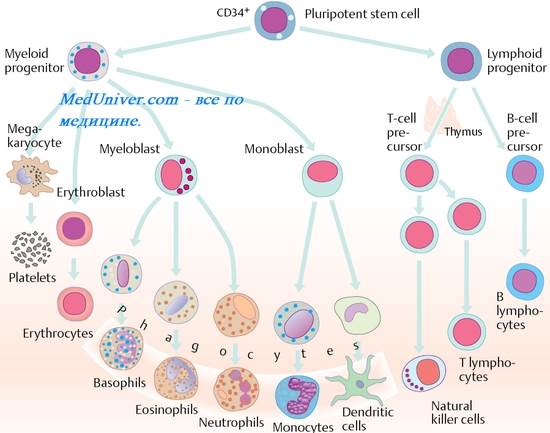
2. एंटीजन - मैक्रोफेज को प्रस्तुत करना। उनकी भूमिका रोगाणुओं के अवशोषण और उनके टी-लिम्फोसाइटों की "प्रस्तुति" है। मैक्रोफेज अपने सभी चरणों में प्रतिरक्षा प्रतिक्रिया में भाग लेते हैं।
मैक्रोफेज के लिए विशेष नाम हैं: कुफ़्फ़ार कोशिकाएँ (जिगर में स्ट्रेलेट मैक्रोफेज) वायुकोशीय (फेफड़ों में मैक्रोफेज), एपिडर्मोसाइट्स ( लैंगरहैंस सेल) त्वचा के उपकला में, अस्थिशोषकों अस्थि ऊतक में, लसीका प्रणाली में गुजरने वाले मोनोसाइट्स - कहा जाता है - वृक्ष के समान कोशिकाएं .
सभी फागोसाइट्स की संरचना इस आधार पर भिन्न हो सकती है कि वे किस अंग में स्थानीयकृत हैं, लेकिन उन सभी में सामान्य गुण हैं: साइटोप्लाज्म की एक बड़ी मात्रा; फार्म स्यूडोपोडिया (स्यूडोपोड्स), जो एंटीजन (ए / जी) पर कब्जा करता है; बड़ी संख्या में एंजाइम होते हैं। फागोसाइट एंजाइम ग्रैन्यूल में होते हैं - लाइसोसोम उनमें 80 से अधिक प्रकार के एंजाइम हो सकते हैं।
लाइसोजाइम- फागोसाइट्स, प्लेटलेट्स में पाया जाने वाला एक एंजाइम, बैक्टीरिया झिल्ली के संश्लेषण को बाधित करता है। रक्त में लाइसोजाइम का मुख्य स्रोत मैक्रोफेज हैं।
एंजाइम एम / ओ कोशिकाओं पर अलग-अलग तरीकों से कार्य करते हैं: हैजा विब्रियो की कोशिका में, वे साइटोप्लाज्म की ग्रैन्युलैरिटी के गठन का कारण बनते हैं, कोक्सी में वे सूजन की ओर ले जाते हैं, और फिर पूर्ण विनाश करते हैं।
फागोसाइटोसिस चरणों
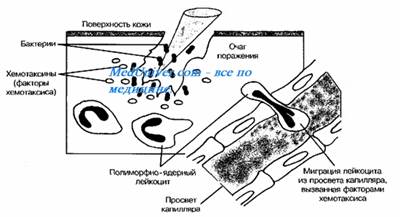
1) केमोटैक्सिस
2) आसंजन - रिसेप्टर्स के कारण फागोसाइट्स के लिए एम / ओ का आसंजन
3) फागोसोम
4) फैगोलिसोसम
फैगोसाइटोसिस कोशिकाओं द्वारा विदेशी कणों के अवशोषण की प्रक्रिया है जो रिसेप्टर्स एक विदेशी एजेंट (उदाहरण के लिए, बैक्टीरिया) से बंधने के बाद होती है। फिर फैगोसाइट जीवाणु को घेर लेता है और उसे अवशोषित कर लेता है। एक मानव न्यूट्रोफिल द्वारा एक जीवाणु के फागोसाइटोसिस लगभग 9 मिनट में होता है। फैगोसाइट के अंदर, जीवाणु फागोसोम का हिस्सा है। एक मिनट के भीतर, फागोसोम एक लाइसोसोम या ग्रेन्युल के साथ विलय हो जाता है जिसमें एक फैगोलिसोसम बनता है। एक कैदी जीवाणु कुछ ही मिनटों के बाद मर जाता है। डेंड्राइटिक कोशिकाएं और मैक्रोफेज इतने तेज़ नहीं होते हैं और इन कोशिकाओं में फैगोसाइटोसिस कई घंटों तक हो सकता है। मैक्रोफेज विदेशी सामग्री की एक बड़ी मात्रा को अवशोषित करते हैं और अक्सर कुछ अशिक्षित कणों को वापस स्रावित करते हैं। यह सामग्री रक्त से मैक्रोफेज के प्रवास के लिए एक संकेत है। फागोसाइट्स लगभग किसी भी पदार्थ को अवशोषित करने में सक्षम हैं।
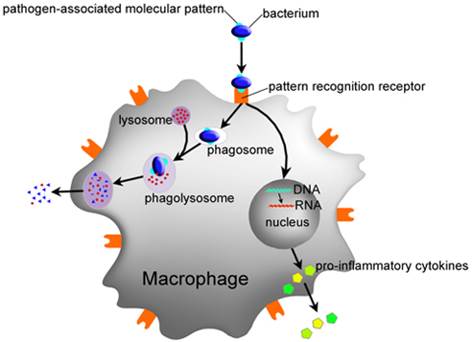
एम / ओ की मृत्यु के साथ समाप्त होने वाली प्रक्रिया को पूर्ण फागोसिटोसिस कहा जाता है, और वह प्रक्रिया जिसमें एम / ओ नहीं मरते हैं और यहां तक \u200b\u200bकि गुणा (गोनोरिया, तपेदिक, काली खांसी, ब्रुसेलोसिस) को फाल्गोसिटोसिस कहा जाता है .
 फागोसाइट्स के जीवाणुनाशक गुण लाइसोसोम और एंजाइम गतिविधि की संख्या से निर्धारित होते हैं। फागोसाइटोसिस को प्रोटीन ओप्सिन्स द्वारा बढ़ाया जाता है, क्योंकि ऑप्सिन द्वारा बाध्य ए / जी फागोसाइट की सतह पर अधिक आसानी से adsorbed है।
फागोसाइट्स के जीवाणुनाशक गुण लाइसोसोम और एंजाइम गतिविधि की संख्या से निर्धारित होते हैं। फागोसाइटोसिस को प्रोटीन ओप्सिन्स द्वारा बढ़ाया जाता है, क्योंकि ऑप्सिन द्वारा बाध्य ए / जी फागोसाइट की सतह पर अधिक आसानी से adsorbed है।
विभिन्न रोगों में, फागोसाइट या तो प्राथमिक भूमिका निभाता है, जो सुरक्षा का मुख्य कारक है या सहायक कार्य करता है।
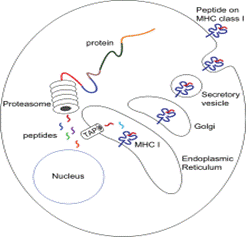
एक / जी मैक्रोफेज की प्रस्तुति
विदेशी पेप्टाइड्स एमएचसी 1 अणुओं की प्रस्तुति योजना
एंटीजन प्रस्तुति एक प्रक्रिया है जिसमें कुछ फागोसाइट्स अवशोषित सामग्री के कुछ हिस्सों को उनकी सतह पर वापस ले जाते हैं और उन्हें प्रतिरक्षा प्रणाली के अन्य कोशिकाओं में "वर्तमान" करते हैं। "पेशेवर" एंटीजन-प्रेजेंटिंग सेल 2 प्रकार के होते हैं: मैक्रोफेज और डेंड्राइटिक सेल। उठने के बाद, विदेशी प्रोटीन (एंटीजन) को डेंड्राइटिक सेल या मैक्रोफेज के अंदर पेप्टाइड्स में बदल दिया जाता है। ये पेप्टाइड्स फिर सेल के मुख्य हिस्टोकोम्पैटिबिलिटी कॉम्प्लेक्स (एमएचसी) के ग्लाइकोप्रोटीन अणु को बांधते हैं, जो फैगोसाइट की सतह पर लौटता है, जहां उन्हें लिम्फोसाइटों के लिए "प्रस्तुत" किया जा सकता है।
लेकिन डेंड्रिटिक कोशिकाएं लिम्फोसाइटों की गतिविधि को नष्ट करने या बाधित करने में सक्षम होती हैं यदि वे मेजबान शरीर के घटकों को पहचानते हैं; यह ऑटोइम्यून प्रतिक्रियाओं को रोकने के लिए महत्वपूर्ण है। इस प्रक्रिया को सहिष्णुता कहा जाता है।
फागोसाइट्स की गतिविधि शरीर की स्थिति, केंद्रीय तंत्रिका तंत्र, पोषण, आयु पर निर्भर करती है।
पेज 1
प्राकृतिक प्रतिरक्षा प्राकृतिक रूप से सचेत मानव हस्तक्षेप के बिना उत्पन्न होती है, उदाहरण के लिए, एक संक्रामक बीमारी के परिणामस्वरूप। कुछ संक्रामक रोगों (चेचक, खसरा, टाइफाइड बुखार, आदि) के बाद, प्रतिरक्षा लंबे समय तक बनी रहती है, कभी-कभी जीवन के लिए, दूसरों के बाद (फ्लू) - थोड़े समय के लिए। कुछ रोगों के लिए प्राकृतिक प्रतिरक्षा - खसरा, लाल रंग का बुखार, डिप्थीरिया, जीवन के पहले महीनों में बच्चों में भी देखा जाता है, जो उन माताओं से प्राप्त सुरक्षात्मक निकायों के संरक्षण से जुड़ा हुआ है जिन्हें अतीत में ये बीमारियां हुई थीं।
संक्रामक बीमारी के बाद सक्रिय रूप से अधिग्रहित प्राकृतिक प्रतिरक्षा होती है। यह सबसे टिकाऊ, लंबे समय तक चलने वाली प्रतिरक्षा है, जो कभी-कभी जीवन भर समर्थित होती है। इस तरह की प्रतिरक्षा टीकाकरण के 1 से 2 सप्ताह बाद होती है और इसे अपेक्षाकृत लंबे समय तक बनाए रखा जाता है - वर्षों और दसियों वर्षों तक।
निष्क्रिय रूप से प्राप्त प्राकृतिक प्रतिरक्षा एक भ्रूण या नवजात शिशु की प्रतिरक्षा है जो नाल के माध्यम से या स्तन के दूध के माध्यम से मां से एंटीबॉडी प्राप्त करती है। इस संबंध में, कुछ समय के लिए नवजात शिशु कुछ संक्रमणों के लिए प्रतिरक्षा बने रहते हैं, उदाहरण के लिए, खसरा।
प्राकृतिक प्रतिरक्षा के कारकों द्वारा विकसित सामान्य साइटोलिसिस प्रतिक्रियाओं को किसी भी वस्तु के संबंध में काफी बढ़ाया जा सकता है जब इस एंटीजन के लिए विशिष्ट एंटीबॉडी के साथ हत्यारा कोशिकाओं को मजबूत करना।
यह याद रखना चाहिए कि कॉर्टिकोस्टेरॉइड उपकला को धीमा करते हैं, प्राकृतिक प्रतिरक्षा को कम करते हैं, इसलिए कंजंक्टिवा के वायरल घावों के लिए उनका उद्देश्य और उपयोग सीमित किया जाना चाहिए और बायोमाइक्रोस्कोपी के नियंत्रण में किया जाना चाहिए।
त्वचा के डिफ्थीरिया के साथ-साथ नासॉफिरिन्क्स के डिप्थीरिया से प्राकृतिक प्रतिरक्षा का विकास हो सकता है, साथ ही संपर्क करने पर नासॉफिरिन्क्स के संक्रमण का स्रोत बन सकता है। डिप्थीरिया के प्रकोप के साथ, किसी को त्वचा के संक्रमण के बारे में नहीं भूलना चाहिए, खासकर उष्णकटिबंधीय देशों में।
डीसीपी; प्राकृतिक संबंध; एक बाहरी उज़ाल्ट द्वारा बंधे; - एफएफआई और गर्भाधान; आत्म बोने; - एस प्राकृतिक प्रतिरक्षा।
Siderophilins की एक अन्य महत्वपूर्ण भूमिका बैक्टीरिया और ट्यूमर के ऊतकों के लिए लोहे की उपलब्धता को सीमित करना है, और इसलिए वे प्राकृतिक प्रतिरक्षा की एक स्वतंत्र प्रणाली का प्रतिनिधित्व करते हैं। एक मुर्गी के अंडे में सारा लोहा फॉसविटिन के भाग के रूप में होता है। लेकिन यह लोहा बैक्टीरिया के लिए व्यावहारिक रूप से दुर्गम है, क्योंकि अंडे के प्रोटीन में वे कॉनलबुमिन के संपर्क में होते हैं, जो मजबूती से लोहे को बांधता है और इस तत्व के बैक्टीरिया को उनके विकास के लिए आवश्यक से वंचित करता है। अंडा प्रोटीन के बैक्टीरियोस्टेटिक गुण काफी हद तक इस विशेषता पर आधारित हैं।
फाइटोनाइड्स पौधों द्वारा उत्पादित जीवाणुनाशक, कवकनाशी और प्रोटिस्टोइडल पदार्थ हैं जो पौधों के समुदायों में जीवों के संबंधों में महत्वपूर्ण भूमिका निभाते हैं और पौधे की प्राकृतिक प्रतिरक्षा के कारकों में से एक हैं।
यह सर्वविदित है कि जानवरों की कई प्रजातियाँ कुछ जीवाणुओं से प्रतिरक्षित होती हैं, जबकि अन्य प्रजातियाँ आसानी से उनसे संक्रमित हो जाती हैं। उच्चतर जानवरों में प्राकृतिक प्रतिरक्षा या तो एंटीबॉडी के उनके शरीर में मौजूदगी के कारण होती है जो शरीर में प्रवेश करने वाले जीवाणुओं के साथ संपर्क करते हैं, या प्रतिक्रियाशील समूहों की अनुपस्थिति से जिनके साथ ये जीवाणु या उनके द्वारा स्रावित उत्पाद प्रतिक्रिया कर सकते हैं।
प्राकृतिक और कृत्रिम प्रतिरक्षा के बीच अंतर। प्राकृतिक प्रतिरक्षा को जन्मजात और अधिग्रहण किया जा सकता है। जन्मजात प्रतिरक्षा माता-पिता से संतानों द्वारा विरासत में मिली है (लोगों के जन्म से उनके रक्त में एंटीबॉडी हैं), यह एक प्रजाति का संकेत है, उदाहरण के लिए, लोग मवेशी प्लेग से संक्रमित नहीं हैं।
लेकिन जीनों का भविष्य भाग्य इस बात पर निर्भर करता है कि एक व्यक्ति और समाज इस जीवन का संपूर्ण निपटान कैसे करते हैं, और इसलिए, जीन। जीन एक रोग के लिए प्राकृतिक प्रतिरक्षा के लिए जिम्मेदार हैं और दूसरों के लिए पूर्वसूचक हैं, लेकिन वे स्वयं समाज में स्वास्थ्य देखभाल की स्थिति पर निर्भर करते हैं।
30 दिनों के लिए प्रति जानवर 200 मिलीग्राम के साथ इलाज किए गए चूहों में, प्राकृतिक प्रतिरक्षा का दमन, आंतों के डिस्बिओसिस का विकास, एलर्जी ल्यूकोसाइट परिवर्तन में वृद्धि हुई है। हिस्टोकेमिकल: जिगर की कोशिकाओं का हल्का मोटापा।
प्रतिरक्षा - यह शरीर को जीवित शरीर और पदार्थों (एंटीजन - एएच) से बचाने का एक तरीका है जो एक एलियन के संकेतों को सहन करता है।
प्राकृतिक और कृत्रिम प्रतिरक्षा के बीच अंतर।
प्राकृतिक प्रतिरक्षा जन्मजात और अधिग्रहण किया जा सकता है। जन्मजात प्रतिरक्षा शरीर की आनुवंशिक रूप से निर्धारित विशेषताओं के कारण होती है। जन्म से, एक व्यक्ति कई बीमारियों से प्रतिरक्षा करता है। ऐसी प्रतिरक्षा को जन्मजात कहा जाता है। उदाहरण के लिए, लोग जानवरों के प्लेग से पीड़ित नहीं होते हैं, क्योंकि उनके रक्त में पहले से ही तैयार एंटीबॉडी हैं। जन्मजात प्रतिरक्षा माता-पिता से विरासत में मिली है। नाल के माध्यम से या माँ से शरीर को एंटीबॉडी प्राप्त होता है ...
स्तन का दूध। इसलिए, अक्सर उन बच्चों में जो स्तनपान करते हैं, प्रतिरक्षा कमजोर हो जाती है। वे संक्रामक रोगों के लिए अधिक संवेदनशील हैं। जन्मजात प्रतिरक्षा जीवन भर रहती है, लेकिन इसे दूर किया जा सकता है यदि संक्रमित एजेंट की खुराक बढ़ जाती है या शरीर के सुरक्षात्मक कार्य कमजोर हो जाते हैं।
प्राकृतिक प्राप्तएक बीमारी के बाद प्रतिरक्षा होती है। एक बार बीमार होने के बाद, लोग रोगज़नक़ के लिए प्रतिरक्षा प्राप्त करते हैं। ऐसी प्रतिरक्षा दशकों तक बनी रह सकती है। उदाहरण के लिए, खसरा के बाद, जीवन भर प्रतिरक्षा बनी रहती है। लेकिन अन्य संक्रमणों के साथ, जैसे फ्लू, गले में खराश, प्रतिरक्षा अपेक्षाकृत कम समय तक रहती है, और एक व्यक्ति अपने जीवन के दौरान कई बार इन बीमारियों को स्थानांतरित कर सकता है।
कृत्रिम (अधिग्रहित) प्रतिरक्षा सक्रिय और निष्क्रिय हो सकता है। सक्रियकृत्रिम प्रतिरक्षा एक वैक्सीन की शुरूआत के परिणामस्वरूप बनती है जिसमें संक्रमण (एंटीजन) के कमजोर या मारे गए रोगजनकों होते हैं। इस मामले में, शरीर अपने स्वयं के एंटीबॉडी के विकास में सक्रिय रूप से शामिल है, और ऐसी प्रतिरक्षा लंबे समय तक बनी रहती है। एंटीबॉडी जो इस तरह की प्रतिरक्षा उत्तेजना के परिणामस्वरूप बनती हैं, जीवन भर रह सकती हैं, जो व्यक्ति को बार-बार संपर्क करने के लिए प्रतिरोधी बनाती है, जैसे कि चिकनपॉक्स, संक्रामक मम्प्स, रूबेला। जनसंख्या का संपूर्ण टीकाकरण कार्यक्रम इसी प्रभाव पर आधारित है।
प्राप्त निष्क्रिय प्रतिरक्षा तैयार है कि तैयार एंटीबॉडी के शरीर में परिचय के साथ सीरा में निहित है। यह तब होता है जब एक बीमार व्यक्ति बीमार लोगों या जानवरों के रक्त सीरम के साथ इंजेक्शन होता है। सक्रिय प्रतिरक्षा तुरंत नहीं बनती है, लंबे समय तक रहता है, निष्क्रिय तुरंत विकसित होता है, लेकिन लंबे समय तक नहीं रहता है। तदनुसार, सक्रिय प्रतिरक्षा (टीके) का उपयोग रोकथाम के लिए किया जाता है, और निष्क्रिय (एंटीबॉडी के साथ सीरम) का उपयोग संक्रामक रोगों के इलाज के लिए किया जाता है। संक्रामक प्रतिरक्षा हमेशा विशिष्ट या दूसरे शब्दों में, विशिष्ट होती है। यह केवल एक विशिष्ट रोगज़नक़ के खिलाफ निर्देशित होता है और दूसरों पर लागू नहीं होता है।
सूक्ष्मजीव (बैक्टीरिया, कवक, प्रोटोजोआ, वायरस) को अक्सर बहिर्जात एएच के लिए संदर्भित किया जाता है, और वायरस, ज़ेनोबायोटिक्स, उम्र बढ़ने, रोग प्रसार, और अन्य द्वारा संशोधित मानव कोशिकाएं अंतर्जात हैं।
विदेशी एजेंटों से मनुष्यों की सुरक्षा प्रतिरक्षा प्रणाली द्वारा प्रदान की जाती है, जिसमें केंद्रीय और परिधीय अंग होते हैं। पहले में अस्थि मज्जा और थाइमस ग्रंथि शामिल है, दूसरा - प्लीहा, लिम्फ नोड्स, श्लेष्म झिल्ली और त्वचा से जुड़े लिम्फोइड ऊतक (छवि 1)।
प्रतिरक्षा प्रणाली का मुख्य कोशिका एक लिम्फोसाइट है। इसके अलावा, ऊतक मैक्रोफेज, न्यूट्रोफिल, और प्राकृतिक हत्यारे (ईसी) भी प्रतिरक्षा प्रतिक्रिया प्रदान करने में शामिल हैं।
बच्चों में प्रतिरक्षा प्रणाली की विशेषताएं:
1) फेगोसाइटोसिस सिस्टम की अपरिपक्वता (फेगोसाइटोसिस की अपूर्णता);
2) प्राकृतिक हत्यारों की अपरिपक्वता;
3) इंटरफेरॉन के संश्लेषण में कमी;
4) बढ़े हुए लाइसोजाइम संश्लेषण;
5) थाइमस की उच्च कार्यात्मक गतिविधि।
चमड़ा - नवजात शिशुओं में, त्वचा पतली, सूखी, ढीली, स्थानीय प्रतिरक्षा की अपरिपक्वता है, जो संक्रमण और विनाशकारी-नेक्रोटिक परिवर्तन के आसपास एक सेल बैरियर बनाने में असमर्थ हैं, प्रवेश द्वार पर (वयस्कों में - यांत्रिक संरक्षण और, जीवाणुनाशक कार्रवाई के लिए धन्यवाद, जल्दी से एंटीजन को हटा दें)।
लिमो नोड्स(रोगज़नक़ के लिए अगला अवरोध) नवजात शिशुओं में पर्याप्त रूप से विभेदित नहीं होता है, एक ढीला कैप्सूल होता है, अच्छी तरह से संवहनीकृत होता है, जिसके कारण बैक्टीरिया को साइनस में खराब बनाए रखा जाता है और मैक्रोफेज द्वारा खराब बनाए रखा जाता है, जो सामान्यीकृत और सेप्टिक रूपों की ओर जाता है।
Phagocytosis। एक बच्चा बढ़े हुए फैगोसाइटिक गतिविधि के साथ पैदा होता है, लेकिन यह केवल आंदोलन और अवशोषण है, और 4 वें चरण (पाचन) में काफी कमी आई है और केवल 6-12 महीनों में एक वयस्क के आकार तक पहुंच जाता है। फागोसाइटिक कार्यों का दोष लिम्फ नोड्स में वृद्धि से प्रकट होता है।
पूरक (मट्ठा प्रोटीन प्रणाली) एंटीजन-एंटीबॉडी परिसरों के लसीका को बाहर करता है, प्रतिरक्षा आसंजन की प्रतिक्रिया निर्धारित करता है, फेगोसाइटोसिस को बढ़ाता है। एक बच्चा 50% की कम गतिविधि के साथ पैदा होता है, लेकिन 1 महीने तक एक वयस्क के स्तर तक पहुंच जाता है। इसलिए, यदि जन्म के बाद से बच्चे में प्यूरुलेंट संक्रमण का पुनरावृत्ति पाठ्यक्रम है, तो यह जन्मजात अपर्याप्तता है।
properdin - एक सीरम प्रोटीन, एक प्रशंसा के साथ मिलकर, फागोसाइटोसिस को बढ़ाता है, सेल लसीका में भाग लेता है, नवजात शिशुओं में इसका स्तर कम हो जाता है, लेकिन 1-3 सप्ताह से बढ़ जाता है।
लाइसोजाइम- एक एंजाइम जो बैक्टीरिया की झिल्ली के म्यूकोपॉलीसेकेराइड को नष्ट कर देता है, जो एक जीवाणुरोधी अवरोध बनाता है। लाइसोजाइम श्वेत रक्त कोशिकाओं, बलगम, लार, रक्त, श्वसन पथ, आंतों के श्लेष्म झिल्ली और स्तन के दूध में पाया जाता है। बच्चे लाइसोजाइम की एक उच्च सामग्री के साथ पैदा होते हैं, और फिर यह घट जाती है।
इंटरफेरॉन प्रोटीन वायरस से संक्रमित कोशिकाओं द्वारा उत्पादित, वायरस के समानांतर प्रजनन के साथ। इसमें वायरस के प्रजनन को दबाने, सभी कोशिकाओं, विशेष रूप से सफेद रक्त कोशिकाओं का उत्पादन करने की क्षमता है। जन्म के बाद, अधिकतम राशि 12-16 वर्ष तक कम हो जाती है।
निष्कर्ष: बच्चे का जन्म गैर-विशिष्ट सुरक्षा कारकों की अपेक्षाकृत उच्च सामग्री के साथ हुआ है, समय से पहले शिशुओं में इन कारकों की सामग्री कम हो जाती है। लेकिन इन संकेतकों को अपरिपक्वता और तेजी से थकावट की विशेषता है।
सबसे बड़ी प्रतिरक्षाविहीनता 6 महीने से 1.5 से 2 साल तक है। इस समय, बच्चा निष्क्रिय प्रतिरक्षा खो देता है, जबकि अपने स्वयं के एंटीबॉडी विकसित करने की क्षमता कम होती है, यह इस उम्र के बच्चों की तीव्र श्वसन वायरल संक्रमण, गैस्ट्रोइंटेस्टाइनल संक्रमण और अन्य वायरल और बैक्टीरियल संक्रमणों की आसान संवेदनशीलता की व्याख्या करता है।
एक बढ़ते जीव की प्रतिरक्षा की कार्यात्मक क्षमताओं को समझने के लिए, इसके गठन के शरीर विज्ञान को जानना महत्वपूर्ण है, जो विकास के पांच महत्वपूर्ण अवधियों की उपस्थिति की विशेषता है।
बच्चे की प्रतिरक्षा की महत्वपूर्ण अवधि(कज़मीरचुक वी.ई., कोवलचुक एल.वी., 2006)
मैं महत्वपूर्ण अवधि - नवजात शिशु की अवधि (जीवन के 28 दिनों तक)। बच्चे की प्रतिरक्षा प्रणाली दबा दी जाती है। प्रतिरक्षा निष्क्रिय है और मातृ एंटीबॉडी द्वारा प्रदान की जाती है। इस अवधि के दौरान, सशर्त रूप से रोगजनक, पाइोजेनिक, ग्राम नकारात्मक माइक्रोफ्लोरा के लिए कमजोर प्रतिरोध है; प्युलुलेंट-भड़काऊ प्रक्रियाओं के सामान्यीकरण की प्रवृत्ति, सेप्टिक स्थितियों की घटना; वायरल संक्रमण के लिए उच्च संवेदनशीलता। 0.5% शिशुओं में जन्मजात वायरल संक्रमण के लक्षण हैं। निमोनिया की उच्च घटना, जटिलताओं के साथ पाठ्यक्रम। वायरल और बैक्टीरियल संक्रमणों के शुरुआती सामान्यीकरण की प्रवृत्ति। कमजोर एंटीट्यूमोर सुरक्षा।
द्वितीय महत्वपूर्ण अवधि - 3 - 6 महीने का जीवन। इस अवधि के दौरान, रक्त सीरम में इम्युनोग्लोबुलिन के स्तर में एक क्षणिक कमी सबसे अधिक स्पष्ट है। प्रतिरक्षा प्रतिक्रिया प्रतिरक्षा स्मृति के संरक्षण के बिना अधिकांश भाग प्राथमिक के लिए है। टीकाकरण प्रतिरक्षा स्मृति के गठन में प्रवेश नहीं करता है, और केवल टीकाकरण एक द्वितीयक प्रतिरक्षा प्रतिक्रिया बनाता है। 4-5 महीने की उम्र में। टी-सेल इम्युनोडेफिशिएंसी डेब्यू। लगभग 6 महीने की उम्र में, एंटीबॉडी उत्पादन की शुरुआत कम हो जाती है। तीव्र श्वसन वायरल संक्रमण (अक्सर) के लिए उच्च संवेदनशीलता। खसरा और काली खांसी अतीन्द्रिय हैं और प्रतिरक्षा नहीं छोड़ते हैं। हेपेटाइटिस बी वायरस शायद ही कभी पीलिया का कारण बनता है।
III महत्वपूर्ण अवधि- दूसरा - जीवन के तीसरे वर्ष। बच्चे के संपर्कों के एक महत्वपूर्ण विस्तार से संक्रामक रोगों की आवृत्ति में वृद्धि होती है, जो अपरिपक्व प्रतिरक्षा तंत्र के विघटन और प्रतिरक्षा विसंगतियों की अभिव्यक्ति की ओर जाता है। तीव्र श्वसन वायरल संक्रमण, ईएनटी रोगों के लिए संवेदनशील।
चतुर्थ महत्वपूर्ण अवधि- जीवन का चौथा - छठा वर्ष। अधिग्रहित प्रतिरक्षा के गठन की अवधि समाप्त होती है। स्थानीय प्रतिरक्षा की कमी के कारण ऊपरी श्वसन पथ के रोग पुराने या आवर्तक हो जाते हैं। बार-बार श्वसन संबंधी संक्रमण।
वी महत्वपूर्ण अवधि- 12 - 13 वर्ष। इस अवधि के दौरान, सेक्स ग्रंथियां सक्रिय रूप से कार्य करना शुरू कर देती हैं, और इसलिए प्रतिरक्षा स्थिति में यौन अंतर नोट किया जाता है। तपेदिक मायकोबैक्टीरिया के लिए अतिसंवेदनशीलता। एलर्जी और ऑटोइम्यून रोग अधिक गंभीर हैं।
प्रतिरक्षा (lat। इम्यूनिटी लिबरेशन, किसी चीज़ से छुटकारा पाना) - संक्रामक और गैर-संक्रामक एजेंटों और उन पदार्थों के लिए शरीर की प्रतिरक्षा जो विदेशी एंटीजेनिक गुण हैं।
लंबे समय तक, मुझे संक्रामक रोगों के लिए एक जीव की प्रतिरक्षा के रूप में समझा गया था। यह राय II मेचनकोव (1903) द्वारा साझा की गई, जिन्होंने लिखा: "संक्रामक रोगों के लिए प्रतिरक्षा के तहत, हमें घटना की सामान्य प्रणाली को समझना चाहिए, जिसके कारण शरीर रोगजनक रोगाणुओं के हमले का सामना कर सकता है।"
भविष्य में, "प्रतिरक्षा" की अवधारणा ने व्यापक व्याख्या प्राप्त की और शरीर की प्रतिरक्षा की स्थिति को न केवल रोगाणुओं के लिए, बल्कि अन्य रोगजनक एजेंटों के लिए भी शामिल करना शुरू कर दिया, उदाहरण के लिए, हेलमिन्थ्स, साथ ही साथ जानवरों या पौधों की उत्पत्ति के विभिन्न विदेशी पर्यावरणीय पदार्थ।
प्रतिरक्षा प्रतिक्रियाएं सुरक्षात्मक, प्रकृति में अनुकूली होती हैं और इसका उद्देश्य विदेशी प्रतिजनों के शरीर को बाहर से प्रवेश करना और इसके आंतरिक वातावरण की कमी का उल्लंघन करना है। ये प्रतिक्रियाएं शरीर में बनने वाले एंटीजन को बायोल, और एक भौतिक रसायन की कार्रवाई के तहत भी शामिल हैं। कारक: बैक्टीरिया, वायरस, एंजाइम, ड्रग्स और अन्य रसायन। दवाओं, विकिरण।
ऑन्कोजेनिक वायरस, कार्सिनोजेन्स कोशिकाओं में नए एंटीजन के उत्पादन को प्रेरित कर सकते हैं, जिसके रूप में शरीर इन एंटीजन को खत्म करने के उद्देश्य से सेलुलर और विनोदी प्रतिरक्षा प्रतिक्रिया के साथ प्रतिक्रिया करता है और, उनके साथ, ट्यूमर कोशिकाएं (एंटीट्यूमर इम्युनिटी देखें)।
इम्यून प्रतिक्रियाएं असंगत आइसोएंटीजेंस (एलोएनिजेंस) पर भी उत्पन्न होती हैं, जो रक्त आधान, अंग और ऊतक प्रत्यारोपण के दौरान शरीर में प्रवेश कर सकती हैं, और एक गैर-समूह गर्भावस्था के दौरान (रक्त समूह, प्रत्यारोपण प्रतिरक्षा, आरएच कारक देखें)।
प्रतिरक्षा संबंधी प्रतिक्रियाएं जो प्रकृति में सुरक्षात्मक होती हैं, एक कारण या किसी अन्य के लिए, न केवल विदेशी प्रतिजनों के लिए विकृत और निर्देशित की जा सकती हैं, जो प्राकृतिक है, बल्कि कोशिकाओं और ऊतकों के कुछ स्वयं, सामान्य, अपरिवर्तित प्रतिजनों के लिए भी है, जिसके परिणामस्वरूप सच्चा ऑटोइम्यून रोग होता है। प्रतिरक्षा प्रतिक्रियाएं शरीर की विदेशी प्रतिजनों के प्रति संवेदनशीलता में वृद्धि का कारण बन सकती हैं - एलर्जी की घटनाएं (देखें) और एनाफिलेक्सिस (देखें)।
आणविक, सेलुलर और सामान्य फिजियोल का अध्ययन। संक्रामक एजेंटों के लिए शरीर की प्रतिरक्षा सुनिश्चित करने वाली प्रतिक्रियाएं I के विज्ञान की मुख्य सामग्री है।
सुरक्षात्मक प्रतिरक्षा प्रतिक्रियाओं की ओटोजेनेसिस और फ़ाइलोजेनेसिस
सुरक्षात्मक प्रतिरक्षा प्रतिक्रियाओं का गठन कार्बनिक दुनिया के लंबे विकास के दौरान किया गया था, विभिन्न एंटीजेनिक कारकों के साथ घनिष्ठ बातचीत में उनका गठन और सुधार हुआ था। उनमें से, रोगाणुओं ने कब्जा कर लिया और पहले स्थान पर ले गए। विभिन्न प्रकार जानवरों, उनकी आनुवंशिक विशेषताओं, साथ ही साथ पर्यावरणीय कारकों के साथ उनकी बातचीत की विशेषताओं के कारण, प्रत्येक प्रजाति में निहित गैर-विशिष्ट और विशिष्ट प्रतिक्रियाएं विकसित हुईं। उत्तरार्द्ध में सुधार किया गया था और फ़्लेगोजेनेसिस की प्रक्रिया में जटिल था। प्रोटोजोआ से शुरू होने वाली सभी जीवित चीजों में रोगाणुओं से प्राथमिक सुरक्षात्मक प्रतिक्रिया फैगोसाइटोसिस (देखें) है। अमीबा फागोसाइटोसिस एक दोहरे कार्य करता है - पोषण और संरक्षण। स्पंज में, पोषण संबंधी कार्य करने वाले कोशिकाओं (एंडोडर्मल फागोसाइट्स) और एक सुरक्षात्मक कार्य (मेसोडर्मल फागोसाइट्स) करने वाले कोशिकाओं में फागोसाइट्स का अंतर पहले से ही रेखांकित है। अधिक उच्च संगठित बहुकोशिकीय जीवों में, इन कोशिकाओं के कार्य का भेदभाव आगे विकसित किया गया था। फागोसाइटिक कोशिकाओं के अलावा, वहाँ दिखाई देने वाली कोशिकाएं विशेष रूप से विदेशी एंटीजन (देखें) को पहचानने में सक्षम थीं, और एंटीबॉडी (उत्पादन) में सक्षम कोशिकाएं। इन कोशिकाओं के बीच एक करीबी बातचीत की स्थापना की जाती है, साथ ही साथ विनोदी पदार्थों और अन्य सामान्य फिजियोल के साथ उनकी बातचीत। कारकों और शरीर प्रणालियों। रोगाणुओं और अन्य विदेशी एंटीजेनिक पदार्थों के खिलाफ शरीर की सेलुलर और विनोदी रक्षा की एक सामंजस्यपूर्ण और परस्पर प्रणाली शरीर में प्रवेश कर रही है। एक नया सुरक्षात्मक तंत्र - एंटीबॉडी का निर्माण - पशु दुनिया का अपेक्षाकृत देर से अधिग्रहण है। यह तंत्र अकशेरूकीय और कुछ आदिम मछलियों में अनुपस्थित है। उनके पास कोई संगठित लिम्फोइड ऊतक नहीं है, और इम्युनोग्लोबुलिन के समान प्रोटीन का कोई उत्पादन नहीं देखा जाता है। पहली बार, एक विशिष्ट प्रतिरक्षा प्रतिक्रिया, हालांकि हल्के, लैंपरेसी में मनाया जाता है। एक अल्पविकसित थाइमस उनमें पाया गया था, और एंटीबॉडी केवल कुछ एंटीजन के लिए बनते हैं और आईजीएम वर्ग के होते हैं। अंतिम शुरू में उत्पन्न होने वाले इम्युनोग्लोबुलिन हैं (देखें)। कार्टिलेजिनस मछली में एंटीबॉडी गठन अधिक प्रभावी है, उदाहरण के लिए, शार्क में, जिनमें से थाइमस पहले से ही अधिक विकसित है, और प्लीहा में भी प्लाज्मा कोशिकाएं हैं - इम्युनोग्लोबुलिन के निर्माता। कार्टिलाजिनस और बोनी मछलियों में, अधिक संगठित कशेरुकियों के विपरीत, प्लाज्मा कोशिकाएं एचएल को संश्लेषित करती हैं। आगमन। आईजीएम। उभयचर और सरीसृप में, इम्युनोग्लोबुलिन के दो वर्ग, आईजीएम और आईजीजी, स्तनधारी आईजीएम और आईजीजी के समान हैं, पहले से ही स्पष्ट रूप से पहचाने जाते हैं। इन इम्युनोग्लोबुलिन का उत्पादन अभी भी खराब विकसित है और परिवेश के तापमान पर निर्भर करता है। पक्षियों में अधिक सही प्रतिरक्षा प्रक्रियाएं। IgM और IgG के अलावा, उन्होंने IgA भी पाया। थाइमस के अलावा, पक्षियों में फैब्रीजिया बैग प्रतिरक्षा कोशिकाओं के गठन के लिए साइट के रूप में कार्य करता है, बी-लिम्फोसाइटों में स्टेम कोशिकाओं का भेदभाव इसमें होता है। यह प्लीहा में जर्मिनल केंद्रों के विकास और प्लाज्मा कोशिकाओं द्वारा इम्युनोग्लोबुलिन के संश्लेषण के तंत्र को नियंत्रित करता है। स्तनधारियों में, थाइमस के अलावा, Peyer की सजीले टुकड़े और परिशिष्ट के लिम्फोइड ऊतक स्पष्ट रूप से पक्षियों में फैब्रिका बैग के समान कार्य करते हैं। इम्यूनोल, पक्षियों में स्मृति अच्छी तरह से विकसित होती है। वे जल्दी से एक ही एंटीजन के माध्यमिक प्रशासन के लिए एक विशिष्ट प्रतिक्रिया के साथ प्रतिक्रिया करने में सक्षम हैं और उच्च टिटर में एंटीबॉडी का निर्माण करते हैं। स्तनधारियों में एंटीबॉडी के गठन का कार्य और भी सही लगता है। कुत्तों, सूअरों, गायों, घोड़ों, खरगोशों, गिनी सूअरों, चूहों और चूहों में इम्युनोग्लोबुलिन के तीन मुख्य वर्ग पाए गए: IgM, IgG, IgA और, कई मामलों में, IgE। मनुष्यों में, इसके अलावा, आईजीडी का पता लगाया जाता है।
ओटोजेनेसिस में प्रतिरक्षा प्रतिक्रियाओं की उपस्थिति और विकास, जैसा कि यह था, संक्षिप्त रूप में अपने फ़ाइग्लोजेनेसिस को दोहराता है। धीरे-धीरे गठन, भेदभाव और लिम्फोइड ऊतक की परिपक्वता भी है, दूसरों द्वारा कुछ इम्युनोग्लोबुलिन के संश्लेषण में परिवर्तन। मनुष्यों में, साथ ही साथ अन्य स्तनधारियों में, वर्ग एम इम्युनोग्लोबुलिन (मैक्रोग्लोबुलिन) का उत्पादन करने वाले प्लाज्मा कोशिकाएं, और बाद में क्लास जी और ए एंटीबॉडी को संश्लेषित करने वाले इम्यूनोसाइट पहले कार्य करना शुरू करते हैं। , और भ्रूण। आईजीएम, आईजीजी और आईजीए का संश्लेषण जन्म के तुरंत बाद शुरू होता है, हालांकि, 3-5 साल तक के बच्चों के रक्त सीरम में इन प्रोटीनों की सामग्री वयस्कों के स्तर तक नहीं पहुंचती है। आईजीडी और आईजीई बच्चे के जीवन के दूसरे वर्ष में दिखाई देते हैं और 10-15 साल तक वयस्कों के स्तर तक पहुंचते हैं।
विभिन्न वर्गों के इम्युनोग्लोबुलिन के उत्पादन के अनुक्रम की एक समान प्रक्रिया प्रयोगात्मक स्थितियों के साथ-साथ किसी व्यक्ति के संक्रमण या टीकाकरण के दौरान देखी जाती है।
क्या एकल प्लास्मोसाइट क्लोन इम्युनोग्लोबुलिन के सभी वर्गों का उत्पादन करता है, या इम्युनोग्लोबुलिन के प्रत्येक वर्ग को केवल इम्यूनोसाइट्स के एक विशिष्ट क्लोन द्वारा संश्लेषित किया जाता है, खराब समझा जाता है।
प्रतिरक्षा के प्रकार
रोगजनक एजेंटों के लिए शरीर की प्रतिरक्षा बनाने वाले तंत्रों के आधार पर, I के दो मुख्य प्रकार प्रतिष्ठित हैं - वंशानुगत और अधिग्रहित।
अंतर्निहित प्रतिरक्षा
वंशानुगत प्रतिरक्षा (समानार्थक: जन्मजात, प्रजातियां, प्राकृतिक, संवैधानिक) एक या दूसरे प्रकार के जानवर या व्यक्ति में अंतर्निहित है और पीढ़ी से पीढ़ी तक अन्य आनुवंशिक पात्रों की तरह विरासत में मिली है। मानव चिकनपॉक्स वायरस, संक्रामक और सीरम हेपेटाइटिस वायरस से पशुओं की प्रतिरक्षा को प्रजातियों I के उदाहरण के रूप में उद्धृत किया जा सकता है। कई जानवरों को खसरा वायरस रोग नहीं हो सकता है। लोग जानवरों के ऐसे वायरल संक्रमण के प्रति प्रतिरक्षित हैं जैसे कि पशु प्लेग, कुत्ते। चूहे और चूहे डिप्थीरिया विष के प्रतिरोधी हैं, और खरगोश, बिल्ली और कुत्ते टेटनस के प्रतिरोधी हैं। रीसस बंदर तीन दिवसीय मलेरिया के प्रेरक एजेंट के लिए प्रतिरक्षा हैं। प्रजातियों के तनाव के विभिन्न डिग्री हैं I - जानवर के पूर्ण प्रतिरोध से लेकर किसी भी सूक्ष्म जीव तक, जो शायद ही कभी मनाया जाता है, सापेक्ष प्रतिरक्षा के लिए, विभिन्न प्रभावों की मदद से किनारे को दूर किया जा सकता है। इन्फ्लूएंजा वायरस के लिए खरगोश के पूर्ण प्रतिरोध को मनुष्यों या चूहों के लिए वायरस रोगजनक की बड़ी खुराक को प्रशासित करने से दूर नहीं किया जा सकता है। प्रजाति I कभी-कभी शरीर के सामान्य प्रतिरोध को कमजोर करके दूर नहीं किया जा सकता है: विकिरण, हाइड्रोकॉर्टिसोन के साथ उपचार, रेटिकुलोएन्डोथेलियल सिस्टम की कोशिकाओं की नाकाबंदी, स्प्लेनेक्टोमी, जानवरों को भूखे आहार पर रखना। एक विशेष प्रकार के सूक्ष्म जीव के सापेक्ष प्राकृतिक प्रतिरक्षा को दूर किया जा सकता है। कृत्रिम रूप से उनके शरीर के तापमान को कम करके एंथ्रेक्स के प्रति प्रतिरक्षा के संक्रमण में एल। पाश्चर के शास्त्रीय अनुभव को जाना जाता है। मेंढक में, शरीर के तापमान में वृद्धि उन्हें टेटनस के लिए अतिसंवेदनशील बनाती है।
प्रजाति I. एक निश्चित प्रकार के सूक्ष्म जीव के लिए आनुवंशिक रूप से निर्धारित है। जैसा कि साबिन (ए। साबिन, 1952) द्वारा दिखाया गया है, चूहों की रॉकफेलर लाइन (PRI) स्विस चूहों की लाइन के विपरीत, पीले बुखार वायरस (स्ट्रेन 17 डी) के लिए 100% प्रतिरोधी थी, जिसमें 100% घटना दिखाई दी। सिकल सेल एनीमिया जीन हीमोग्लोबिन के संश्लेषण को एन्कोडिंग करता है, जो सामान्य तौर पर केवल एक एमिनो एसिड को दूसरे के साथ बदलकर अलग करता है, इन व्यक्तियों की लाल रक्त कोशिकाओं को मलेरिया के प्लास्मोडिया के लिए प्रतिरोधी बनाता है। एक प्रकार के सूक्ष्म जीव के लिए स्वाभाविक रूप से प्रतिरक्षा वाले जानवर दूसरे के लिए अतिसंवेदनशील हो सकते हैं। उदाहरण के लिए, सेंट लुइस वायरस के प्रति प्रतिरोधी वेसक्यूलर स्टामाटाइटिस, रेबीज, लिम्फोसाइटिक कोरिओनिंगाइटिस के वायरस के प्रति संवेदनशील हैं, अर्थात, प्रजाति I एक ऐसी स्थिति है जो सूक्ष्म रूप से परिभाषित प्रकार के सूक्ष्म जीवों के लिए प्रतिरक्षा की विशेषता है। संक्रामक रोगों के लिए अतिसंवेदनशील में भी अंतर या नस्लीय मतभेद हैं। उदाहरण के लिए, एंज़ूटिक प्लेग फ़ॉसी से मिडडे गार्बिल्स इस संक्रमण के लिए कई गुना अधिक प्रतिरोधी होते हैं, गेरबिल्स की तुलना में उन जगहों से पकड़ा जाता है जहाँ प्लेग का कोई प्राकृतिक फ़ॉसी नहीं होता है। जाहिर है, इन जानवरों का प्राकृतिक प्रतिरोध प्लेग के प्रेरक एजेंट के साथ उनके निरंतर संपर्क का परिणाम था। प्राकृतिक चयन की प्रक्रिया में, संक्रमण के लिए प्रतिरोधी किस्में उत्पन्न हुईं। अल्जीरियन भेड़ यूरोपीय भेड़ की तुलना में एंथ्रेक्स के लिए अधिक प्रतिरोधी हैं, जो नस्लीय I की भी विशेषता है।
एक्वायर्ड इम्यूनिटी
अधिग्रहित प्रतिरक्षा पिछले संक्रमण या टीकाकरण (देखें) के परिणामस्वरूप विकसित हो सकती है। प्रजातियों के विपरीत, प्राप्त I, विरासत में नहीं मिला है। अधिग्रहित I की मुख्य विशेषताओं में से एक इसकी सख्त विशिष्टता है। सक्रिय रूप से और निष्क्रिय रूप से अर्जित I के बीच भेद।
सक्रिय रूप से अधिग्रहित प्रतिरक्षा एक नैदानिक \u200b\u200bरूप से स्पष्ट बीमारी के परिणामस्वरूप उत्पन्न हो सकती है और अव्यक्त संक्रमण के परिणामस्वरूप (स्वाभाविक रूप से सक्रिय रूप से आई।), और जीवित या मारे गए टीके (कृत्रिम रूप से अधिग्रहित आई) के साथ टीकाकरण द्वारा भी प्राप्त किया जा सकता है।
सक्रिय रूप से अधिग्रहीत I को तुरंत - 1 - 2 सप्ताह के बाद स्थापित नहीं किया जाता है। या बाद में और अपेक्षाकृत लंबे समय तक रहता है - वर्षों या दसियों वर्षों तक। उदाहरण के लिए, खसरा के हस्तांतरण के बाद, पीला बुखार, आजीवन I रहता है। अन्य वायरल संक्रमण के साथ, उदाहरण के लिए, इन्फ्लूएंजा के साथ, सक्रिय रूप से अधिग्रहित I अपेक्षाकृत 1 - 2 साल तक रहता है।
भ्रूण में निष्क्रिय रूप से अधिग्रहित प्रतिरक्षा इस तथ्य के कारण होती है कि वह नाल के माध्यम से मां से एंटीबॉडी प्राप्त करती है, इसलिए कुछ समय के लिए नवजात शिशु कुछ संक्रमणों के लिए प्रतिरक्षा बने रहते हैं, उदाहरण के लिए, खसरा। निष्क्रिय रूप से अर्जित I को सक्रिय रूप से प्रतिरक्षित लोगों या जानवरों से प्राप्त शरीर इम्युनोग्लोबुलिन में शामिल करके, कृत्रिम रूप से भी बनाया जा सकता है। निष्क्रिय रूप से अधिग्रहित I. जल्दी से स्थापित होता है - प्रतिरक्षा सीरम या इम्युनोग्लोबुलिन की शुरूआत के कई घंटे बाद और थोड़े समय तक रहता है - 3-4 सप्ताह तक। शरीर को 1 से 2 सप्ताह के बाद - तेजी से हेटेरोग्लस सेरा के एंटीबॉडी से मुक्त किया जाता है। इसलिए, I, उनके कारण, कम लंबा है।
संक्रामक प्रक्रिया के परिणाम के आधार पर, अधिग्रहित I के दो रूप प्रतिष्ठित हैं: बाँझ और गैर-बाँझ (संक्रामक)।
जीवाणुरोधी एजेंट से पूरी तरह से मुक्ति के साथ बाँझ प्रतिरक्षा होती है, और बाद में संक्रमण के बाद अलग नहीं किया जा सकता है। हालांकि, कभी-कभी शरीर, प्रतिरक्षा प्राप्त करने, अतिसंवेदनशील लोगों के लिए सूक्ष्म रोगजनक की लंबी या छोटी अवधि के लिए वाहक बन जाता है। सुरक्षात्मक प्रतिक्रियाएं हमेशा शरीर से रोगज़नक़ को पूरी तरह से खत्म करने के लिए पर्याप्त नहीं होती हैं।
अधिग्रहीत I का एक अजीब रूप संक्रामक या गैर-बाँझ है, प्रतिरक्षा, जिसे पहली बार 1891 में आर। कोच द्वारा वर्णित किया गया था। यह शरीर में एक संक्रामक एजेंट की उपस्थिति के कारण होता है और तब तक जारी रहता है जब तक कि इसमें रोगाणुओं को संग्रहीत नहीं किया जाता है। सुरक्षात्मक प्रतिक्रियाओं और रोगजनक रोगाणुओं की गतिविधि के बीच एक अजीब अस्थिर संतुलन स्थापित होता है। शरीर में एक तपेदिक फोकस की उपस्थिति उसे तपेदिक के साथ एक नए संक्रमण के लिए प्रतिरक्षा प्रदान करती है। इसी तरह की घटना वाई। मोर्गेनरोथ (1920) द्वारा भी देखी गई: चूहों में उत्पन्न होने वाले ह्रोन, स्ट्रेप्टोकोकल संक्रमण ने नियंत्रण जानवरों के लिए इस सूक्ष्म जीव की घातक खुराक के साथ पुन: निर्माण के लिए प्रतिरोध की सूचना दी। गैर-बाँझ I की एक विशेषता केवल एक संक्रामक फोकस की उपस्थिति में इसका कार्य है। उत्तरार्द्ध को हटाने से आई के नुकसान के साथ होता है। आनुवंशिक स्तर पर वायरस की एक लंबी और कभी-कभी आजीवन दृढ़ता की संभावना, अर्थात्, सेल जीनोम में कुछ वायरस के डीएनए या डीएनए टेप का समावेश साबित हुआ है। वायरस और कोशिकाओं के अस्तित्व का यह अजीब रूप वायरल और वायरस-प्रेरित एंटीजन दोनों के लिए शरीर की प्रतिरक्षा प्रतिक्रियाओं में अभिव्यक्ति पाता है, जिसे गैर-बाँझ प्रतिरक्षा के रूपों में से एक के रूप में भी माना जा सकता है।
प्रजातियों की उत्पत्ति में मूलभूत अंतर को ध्यान में रखते हुए और प्राप्त I, यह ध्यान में रखा जाना चाहिए कि प्रतिरक्षा के इन दोनों रूपों को अटूट रूप से जोड़ा गया है।
अधिग्रहित I का गठन आनुवंशिक रूप से निर्धारित कारकों और तंत्रों के आधार पर किया जाता है। इम्यूनोरैक्टिव जीन (आईआरजी) एक या दूसरे एंटीजन और प्रतिरक्षा प्रतिक्रिया की ताकत के जवाब की क्षमता निर्धारित करते हैं। वंशानुगत और अधिग्रहीत I दोनों आणविक, सेलुलर और सामान्य फिजियोल पर आधारित हैं। विदेशी प्रतिजनों के लिए शरीर की प्रतिक्रियाएं।
आनुवांशिक विशेषताओं के परिणामस्वरूप या शरीर पर विभिन्न बाहरी प्रभावों के प्रभाव में, सेलुलर या ह्यूमर प्रतिरक्षा प्रतिक्रियाएं कम या ज्यादा कमजोर या परिवर्तित हो सकती हैं, जो विभिन्न इम्युनोडेफिशिएंसी और इम्युनोपैथ का कारण बन सकती हैं। स्थितियां (देखें। प्रतिरक्षात्मक अपर्याप्तता, इम्यूनोपैथोलॉजी)।
प्रजाति I, साथ ही अधिग्रहीत, उम्र के आधार पर बदलती है। कुछ जानवरों की प्रजातियों में, नवजात शिशु इम्युनोग्लोबुलिन को संश्लेषित करने में सक्षम नहीं हैं। नवजात पशु आमतौर पर वयस्कों की तुलना में वायरस के लिए अधिक संवेदनशील होते हैं। उदाहरण के लिए, चूसने वाले चूहों में कॉक्ससेकी वायरस के साथ संक्रमण का कारण बनना आसान है, वयस्क चूहों में इन वायरस के संक्रमण का कारण संभव नहीं है। चिकन भ्रूण में इन्फ्लुएंजा वायरस अच्छी तरह से विकसित होते हैं, लेकिन मुर्गियों में संक्रमण नहीं होता है। नवजात गिनी सूअरों और सफेद चूहों को टिक-जनित एन्सेफलाइटिस वायरस के लिए अतिसंवेदनशील होते हैं, यह वायरस वयस्क जानवरों में गुणा नहीं करता है। संक्रमण को स्थानीय करने की शरीर की क्षमता बच्चों की तुलना में वयस्कों में अधिक स्पष्ट है, जो माइक्रोबियल प्रसार और प्रक्रिया के सामान्यीकरण की अधिक संभावना है। युवा जानवरों में, वयस्कों की तुलना में दृश्य भड़काऊ प्रतिक्रियाएं कम सुनाई देती हैं।
वंशानुगत प्रतिरक्षा के कारक और तंत्र
प्रजाति I, जैसा कि अधिग्रहित है, दो मुख्य कारकों द्वारा निर्धारित किया जाता है: मैक्रोऑर्गेनिज्म की सुरक्षात्मक प्रतिक्रियाओं की विशेषता और सूक्ष्म जीव की प्रकृति, इसकी पौरूष और विषाक्तता।
कोशिका प्रतिक्रियाशीलता प्रजातियों I के कारकों में से एक है। एंटीवायरल प्रजातियों I का आधार वायरस-संवेदनशील कोशिकाओं की अनुपस्थिति है जो इसके प्रजनन का समर्थन करने में सक्षम है।
कई शोधकर्ताओं का मानना \u200b\u200bहै कि कोशिकाओं की गतिविधि, कोशिकाओं की सतह पर वायरल रिसेप्टर्स की अनुपस्थिति के कारण होती है, जिसके परिणामस्वरूप वायरस कोशिकाओं पर सोख नहीं सकते हैं और इसलिए, उनमें प्रवेश करते हैं। हॉलैंड, मैकलेरन (जे। जे। हॉलैंड, एल। सी। मैकलेरन, 1952) और अन्य लोगों द्वारा किए गए अध्ययनों के अनुसार, पॉलीइर्यूज़ के लिए प्राइमेट सेल संस्कृतियों की संवेदनशीलता उनमें उपयुक्त रिसेप्टर्स की उपस्थिति पर निर्भर करती है, और गैर-प्राइमेट कोशिकाओं में उत्तरार्द्ध की अनुपस्थिति पॉलीइर्यूज़ के प्रति उनके प्रतिरोध को निर्धारित करती है। यह प्रकार I पोलियोवायरस से पृथक आरएनए ऊतक संस्कृति के प्रतिरोधी कोशिकाओं के संक्रमण पर प्रयोगों द्वारा पुष्टि की गई थी। प्रोटीन मुक्त आरएनए में पोलियोवायरस प्रतिरोधी कोशिकाओं को घुसाने और उनमें वायरस के प्रजनन को प्रेरित करने की क्षमता होती है। विवो में प्रयोगों में इसी तरह के परिणाम प्राप्त किए गए थे। टाइप I पोलियोवायरस के लिए स्वाभाविक रूप से प्रतिरोधी सफेद चूहे आरएनए वायरस के इंट्रास्पाइनल प्रशासन के साथ बीमार हो गए। यह माना जाता है कि इस वायरस के लिए चूहों का प्रतिरोध सी कोशिकाओं के झिल्ली पर वायरस के लिए रिसेप्टर्स की अनुपस्थिति पर निर्भर करता है। एन। एक।
अतिसंवेदनशील टिशू कल्चर सेल्स पोलियोमाइलाइटिस वायरस के 90% को सोख लेते हैं, और प्रतिरोधी कोशिकाएं 10% से कम सोखती हैं।
इन्फ्लूएंजा वायरस को संक्रमित करने के लिए फेफड़ों के ऊतकों की क्षमता और इन्फ्लूएंजा के लिए जानवरों की संवेदनशीलता की डिग्री के बीच एक निश्चित संबंध है। अफ्रीकी फेरेट्स और मनुष्यों के फेफड़ों के ऊतकों, इन्फ्लूएंजा के लिए अतिसंवेदनशील, सबसे अधिक सोखना गतिविधि है। एक खरगोश के फेफड़ों के ऊतक - एक जानवर जो इन्फ्लूएंजा से प्रतिरक्षित है - वायरस को सोख नहीं लेता है। एक विनाशकारी एंजाइम द्वारा चिकन भ्रूण सेल रिसेप्टर रिसेप्टर्स को निष्क्रिय करने से इन्फ्लूएंजा वायरस को कोशिकाओं की संवेदनशीलता कम हो जाती है। इस प्रकार, संवेदनशील कोशिकाओं में वायरल रिसेप्टर्स की उपस्थिति संक्रमण के लिए पहली और आवश्यक शर्तों में से एक है; वायरल रिसेप्टर्स की अनुपस्थिति में, सेल अपने वायरस के साथ विवो संक्रमण में अजेय है। हालाँकि, विशिष्ट एंटीवायरल I को केवल कोशिकाओं में वायरल रिसेप्टर्स की अनुपस्थिति से ही समझाया जा सकता है। गिनी पिग इन्फ्लूएंजा वायरस के लिए प्रतिरोधी है, हालांकि इसके ऊतकों की कोशिकाएं वायरस को सोख सकती हैं, अर्थात, उनके पास कोशिकाओं की सतह पर समान रिसेप्टर्स होते हैं। जाहिर है, वायरस के लिए प्राकृतिक प्रतिरोध के गठन में सीधे शामिल होने वाले अन्य कारकों और तंत्रों की उपस्थिति को भी मान्यता दी जानी चाहिए। जाहिर है, आनुवंशिक रूप से निर्धारित प्रतिरोध वाली कोशिकाएं प्राकृतिक I से वायरल संक्रमण के निर्माण में अग्रणी स्थान पर कब्जा कर लेती हैं। हालांकि, शरीर के अन्य कारक वायरस के प्राकृतिक प्रतिरोध में भूमिका निभाते हैं। तो, हमेशा एक जानवर से एक वायरल संक्रमण के प्रतिरोध और एक वायरस के लिए इसकी कोशिकाओं के प्रतिरोध के बीच एक पत्राचार होता है। खसरा वायरस, उदाहरण के लिए, चिकन फाइब्रोब्लास्ट कोशिकाओं, गिनी सूअरों के गुर्दे की कोशिकाओं, खरगोशों के लिए संवेदनशील है; हालाँकि, इन पशुओं में प्रायोगिक खसरा संक्रमण नहीं हो सकता है। टिक-जनित एन्सेफलाइटिस वायरस खरगोश गुर्दे की कोशिकाओं की प्राथमिक संस्कृतियों में पुन: पेश किया जाता है - एक जानवर जो इस संक्रमण के लिए प्रतिरक्षा है। एक व्यक्ति क्लासिक प्लेग वायरस से प्रतिरक्षा करता है, हालांकि यह वायरस मानव भ्रूण के फेफड़े के ऊतकों की संस्कृतियों में फैलता है। जाहिरा तौर पर, वायरस और कोशिका के बीच विभिन्न संबंध ऊतक संस्कृतियों की तुलना में प्रतिरोधी जानवरों के जीव में विकसित होते हैं।
टॉक्सिन को जन्मजात I, कोशिकाओं में रिसेप्टर्स की कमी के कारण होता है जो विष को ठीक कर सकता है। उदाहरण के लिए, चूहों में डिप्थीरिया टॉक्सिन के लिए प्रतिरक्षा, बाद में अंग कोशिकाओं द्वारा adsorbed और अपरिवर्तित उत्सर्जित नहीं है। विषाक्त पदार्थों के लिए प्राकृतिक प्रतिरक्षा भी हो सकती है यदि विष के लिए आत्मीयता वाले रिसेप्टर्स अंगों या ऊतकों में स्थानीयकृत होते हैं, जिसमें विष का कोई हानिकारक प्रभाव नहीं होता है। उदाहरण के लिए, एक बिच्छू में, टेटनस विष जिगर की कोशिकाओं द्वारा तय किया जाता है, जो इससे पीड़ित नहीं होते हैं। टेटनस टॉक्सिन से प्रतिरक्षित एक काइमैन में, बाद वाले भी उन कोशिकाओं से बंध जाते हैं जो इसके लिए प्रतिरोधी हैं। टेटनस टॉक्सिन से एक चिकन मर जाता है अगर इसे सीधे मेनिंगेस के तहत पेश किया जाता है, और बीमार नहीं होता है जब इसे रक्त में पेश किया जाता है, क्योंकि टॉक्सिन को सी में पहुंचाया जाता है। एन। एक। यह कोशिकाओं द्वारा इंटरसेप्टेड है जिस पर इसका कोई प्रभाव नहीं पड़ता है।
सामान्य रूप से काम करने वाली त्वचा और श्लेष्म झिल्ली बैक्टीरिया और वायरल संक्रमण से शरीर की रक्षा की पहली पंक्ति का गठन करते हैं। लगातार उतरने वाली त्वचा उपकला संक्रमण के खिलाफ एक विश्वसनीय सुरक्षा के रूप में कार्य करती है, और केवल त्वचा को नुकसान शरीर में रोगजनक एजेंटों के प्रवेश के लिए रास्ता खोलती है। चमड़ा, हालांकि, केवल एक यांत्रिक सुरक्षा नहीं है। पसीने और वसामय ग्रंथियों के स्राव में ऐसे पदार्थ होते हैं जो टाइफाइड, पैराटायफाइड, ई। कोलाई आदि के जीवाणुओं पर हानिकारक प्रभाव डालते हैं। त्वचा के जीवाणुनाशक गुण स्तन और वसायुक्त ऊतकों की पसीने और वसामय ग्रंथियों की सामग्री पर निर्भर करते हैं। त्वचा के आवश्यक और मादक अर्क में निहित वसा-आप और साबुन आंतों के समूह, डिप्थीरिया, स्ट्रेप्टोकोकस के बैक्टीरिया के खिलाफ जीवाणुनाशक कार्रवाई करते हैं।
पेट की अम्लीय सामग्री एक ऐसा माध्यम है जिसमें भोजन के प्रति संवेदनशील कई रोगाणुओं, जैसे हैजा विब्रियो, भोजन और पानी के संपर्क में आते हैं।
स्क्वैमस एपिथेलियम के साथ पंक्तिबद्ध श्लेष्म झिल्ली रोगाणुओं के प्रवेश के खिलाफ एक महत्वपूर्ण बाधा है। श्लेष्म ग्रंथियों के रहस्य भी इसमें योगदान करते हैं। वे न केवल यांत्रिक रूप से कोशिकाओं की सतह से रोगाणुओं को हटाते हैं, बल्कि उन्हें बेअसर भी करते हैं। श्वसन पथ के श्लेष्म झिल्ली को अस्तर करने वाला बेलनाकार उपकला सिलिया से सुसज्जित है, जिसके कारण वे सूक्ष्म रूप से रोगाणुओं सहित शरीर से विदेशी सब्सट्रेट को हटा देते हैं।
वियोज्य श्लेष्मा झिल्ली में लाइसोजाइम (एसिटाइलम्यूरिडेज़) होते हैं - मुख्य प्रोटीन जिसमें एक पॉलीपेप्टाइड श्रृंखला होती है और एक म्यूकोलाईटिक एंजाइम के रूप में कार्य करती है। यह एन-एसिटाइल ग्लूकोसामाइन और एन-एसिटाइलम्यूरिक एसिड को म्यूकोपेप्टाइड (पेप्टिडोग्लाइकन) बैक्टीरिया की दीवार के परिसरों से साफ करता है। नतीजतन, बैक्टीरिया की दीवार नष्ट हो जाती है, इसका लसीका होता है। माइक्रोकॉसी, सार्सिन लाइसोजाइम के प्रति सबसे अधिक संवेदनशील होते हैं। लाइसोजाइम की कार्रवाई के तहत बैक्टीरिया की मृत्यु उनके विघटन के बिना हो सकती है। लाइसोजाइम (देखें) कई ऊतकों और तरल पदार्थों में पाया जाता है। एक उच्च उच्च सांद्रता में, यह फेफड़ों के मैक्रोफेज, कंजाक्तिवा, नाक, आंतों के श्लेष्म और लार के रहस्यों में पाया जाता है। Lysozyme IgA के साथ बातचीत कर सकते हैं और लाइसोजाइम-प्रतिरोधी बैक्टीरिया के lysis का कारण बन सकते हैं। लाइसोजाइम वायरस पर कार्य नहीं करता है। कंजाक्तिवा, कॉर्निया, मौखिक गुहा, नाक और ग्रसनी के श्लेष्म झिल्ली स्टैफिलोकोकी, न्यूमोकोकी, आदि सहित बैक्टीरिया की एक बड़ी संख्या के निरंतर संपर्क में हैं, हालांकि, बैक्टीरिया द्वारा इन श्लेष्म झिल्ली की हार से जुड़े रोग अपेक्षाकृत दुर्लभ हैं। जाहिरा तौर पर, तरल पदार्थ लगातार श्लेष्म झिल्ली को धोते हैं, और उनमें निहित लाइसोजाइम, साथ ही साथ स्रावी एंटीबॉडी, रक्षा तंत्रों में से एक हैं। सामान्य ऊतकों में, बैक्टीरिया की एंजाइमेटिक गतिविधि के विभिन्न अवरोधक निहित हैं। ये हाइलूरोनिडेज़, लेसिथिनेज़, कोलेजनेज़, फ़ॉस्फ़ोलिपेज़, सियालीडेज़, फ़िब्रिनोलिसिन के अवरोधक हैं। वायरस अवरोधक (देखें), वायरस के साथ बातचीत करने और उनकी गतिविधि को बाधित करने में सक्षम हैं, प्राकृतिक I में भी एक महत्वपूर्ण कारक हैं। मानव और पशु सीरा के अवरोधकों में इन्फ्लूएंजा, पैराइन्फ्लुएंजा, कण्ठमाला, टिक-जनित एन्सेफलाइटिस, पोलियो, और अन्य के अवरोधक पाए गए थे। कुछ जानवरों की प्रजातियों में, निरोधकों को कुछ विषाणुओं द्वारा उच्च गतिविधि की विशेषता होती है, दूसरों में यह गतिविधि कम स्पष्ट होती है। उदाहरण के लिए, कुत्तों की लार के अवरोधक, जानवर जो स्वाभाविक रूप से इन्फ्लूएंजा के लिए प्रतिरक्षा हैं, मानव लार की तुलना में इन्फ्लूएंजा वायरस की व्यवहार्यता को दबाने के लिए सबसे स्पष्ट क्षमता है। अवरोधकों की कार्रवाई का तंत्र एंटीबॉडीज के समान है: जब एक वायरस के साथ बातचीत करते हैं, तो एंटीबॉडीज, एंटीबॉडीज की तरह, एक संवेदनशील सेल की सतह पर इसके सोखना और इसे घुसने की क्षमता के साथ हस्तक्षेप करते हैं। एंटीबॉडीज, एंटीबॉडीज की तरह, संवेदनशील सेल के रास्ते में वायरस को बेअसर करने का कार्य करते हैं। संक्रमण या टीकाकरण के आधार पर, अवरोधकों की सामग्री भिन्न हो सकती है। वायरल संक्रमण की शुरुआत में या इन्फ्लूएंजा वायरस के साथ सीधे संपर्क में आने वाले ऊतकों में टीकाकरण, अवरोधकों की संख्या में कमी होती है, और फिर उनकी महत्वपूर्ण वृद्धि होती है। संक्रमण के बाद 11-16 वें दिन, अवरोधकों की संख्या नियंत्रण चूहों के फेफड़ों में उनके स्तर से 5-8 गुना अधिक होती है, और फिर उनकी क्रमिक कमी सामान्य देखी जाती है। स्वस्थ लोगों में लार में वायरस अवरोधकों के टाइटर्स, एक नियम के रूप में, निरंतर नहीं रहते हैं और कुछ निश्चित फ़िज़ियोल के अधीन हैं। मौसमी प्रभावों से स्वतंत्र उतार-चढ़ाव।
गंभीर इन्फ्लूएंजा वाले रोगियों में, स्वस्थ लोगों की तुलना में निरोधकों के टिटर में काफी अधिक परिवर्तन देखे जाते हैं। इन्फ्लूएंजा संक्रमण के विकास की ऊंचाई पर, लगभग आधे जांच किए गए रोगियों में उनके लार में कोई वायरल अवरोधक नहीं था या कम टिटर में पाया गया था।
I. के प्राकृतिक (जन्मजात) कारकों में उचित है (देखें), जीवाणुनाशक गुणों वाला एक सामान्य सीरम प्रोटीन। पूरक या इसके व्यक्तिगत घटकों और मैग्नीशियम आयनों की मौजूदगी में, ग्रामड पॉजिटिव और ग्राम-नेगेटिव बैक्टीरिया पर एक जीवाणुनाशक प्रभाव पड़ता है और वायरस को निष्क्रिय करता है। विभिन्न जानवरों में उचित सामग्री की मात्रा समान नहीं है; चूहे सीरम इसमें सबसे अमीर हैं। उचित मात्रा की क्रिया, जैसे कि लाइसोजाइम, बकवास है। सम्यक्त्व की प्रकृति और पूरक के संबंध का प्रश्न अपर्याप्त रूप से स्पष्ट है।
रोगाणुरोधी I के गैर-विशिष्ट humoral कारकों में ल्यूकेन्स और बीटा-लाइसिन हैं।
थर्मोस्टेबल ल्यूकिंस (टी ° 75 ° तक हीटिंग का सामना करना) जीवाणुनाशक पदार्थ हैं जो उनके विनाश पर ल्यूकोसाइट्स से निकलते हैं। विभिन्न प्रजातियों के जानवरों से प्राप्त ल्यूकेन्स उनकी जीवाणुनाशक गतिविधि और विभिन्न रोगाणुओं के संबंध में उनकी कार्रवाई की दिशा में असमान हैं। ल्यूकीन्स के समान, प्लेटलेट्स से निकाले गए पदार्थ प्लाक कहलाते थे। एक और थर्मास्टेबल (t ° 63-70 ° पर निष्क्रिय) जीवाणुनाशक कारक पशु सीरा में पाया जाता है और इसे बीटा-लाइसिन कहा जाता है। गर्मी-निष्क्रिय निष्क्रिय बीटा-लाइसिन को थोड़ी मात्रा में ताजा सामान्य सीरम जोड़कर बहाल किया जा सकता है। ल्यूसीन की तरह, सीरम बीटा-लाइसिन टीकाकरण के साथ नहीं बढ़ता है। स्टेफिलोकोसी और एनारोबेस के संबंध में बीटा-लाइसिन गतिविधि ल्यूकिन से अधिक है। गैर-विशिष्ट रक्त कारक जैसे कि सी-प्रतिक्रियाशील प्रोटीन (देखें) और कोन्ग्लुटिनिन प्रतिरक्षा प्रतिक्रियाओं में माध्यमिक हैं। I. में उनका महत्व अभी भी पर्याप्त नहीं है।
प्राकृतिक I में एक महत्वपूर्ण कारक पूरक है - एंजाइमी गुणों के साथ मट्ठा प्रोटीन की एक जटिल प्रणाली। पूरक में विभिन्न घटक होते हैं (देखें। पूरक)। प्राकृतिक परिस्थितियों में, पूरक बनाने वाले घटक निष्क्रिय हैं, हालांकि, एंटीजन-एंटीबॉडी परिसर के गठन के साथ, पूरक प्रणाली सक्रिय है। एक एंटीजन - एंटीबॉडी जाली परिसर का गठन पूरक सक्रियण को बढ़ावा देता है। सक्रियण प्रक्रिया शुरू करने के लिए एक आईजीएम अणु या दो आईजीजी अणु पर्याप्त हैं। यदि एंटीबॉडी और एंटीजन समान मात्रा में नहीं हैं (उदाहरण के लिए, एंटीजन की अधिकता है), तो जाली संरचना नहीं बनती है और पूरक कुछ हद तक जुड़ा हुआ है। एक जाली बनाने वाले मोनोवालेंट एंटीबॉडी पूरक को सक्रिय नहीं करते हैं। प्रतिजन, एंटीबॉडी अणु के साथ संयोजन करके, अपने एफसी क्षेत्र को बदलता है, जिसके परिणामस्वरूप C1q घटक और फिर C1r और C1s दृढ़ता से उत्तरार्द्ध से जुड़े होते हैं। इस बातचीत के लिए, सीए आयनों की आवश्यकता होती है। घटक C1s - proesterase घटक C1q और C1r के जुड़ने के बाद सक्रिय एस्टेरेज़ में बदल जाता है, जो पूरक के अन्य घटकों के कामकाज के लिए आवश्यक है। परिणामी परिसर C4 घटक को बदलता है, जिसके परिणामस्वरूप उत्तरार्द्ध सेल या एंटीजन-एंटीबॉडी परिसर की सतह से जुड़ जाता है, और C2 घटक भी इसे संलग्न करता है। इस प्रक्रिया के लिए मैग्नीशियम आयनों की आवश्यकता होती है। C3 घटक अगली बार श्रृंखला प्रतिक्रिया में शामिल है, C3a और C3b अंशों के क्षय के बाद, बाद कोशिका झिल्ली से जुड़ा हुआ है। गठित नए कॉम्प्लेक्स में कई महत्वपूर्ण बायोल, गुण हैं, यह फागोसाइटोसिस को बढ़ावा देता है, इम्यूनोएडेसियन की प्रतिक्रिया में भाग लेता है (देखें। इम्यून पालन) और कंज्लूटिनेशन (देखें), लसीका के लिए आवश्यक है। हालांकि, केवल घटकों C5, C6, C7, C8 और C9 के लगाव से कोशिका झिल्ली को अपरिवर्तनीय क्षति होने की क्षमता मिलती है। कोशिका झिल्लियों में दीया छिद्र दिखाई देता है। 10 एनएम, जिसके परिणामस्वरूप छोटे अणु कोशिका में प्रवेश कर सकते हैं और छोड़ सकते हैं। सेल लाइसोसोम और इसकी मृत्यु सहित संरचना और कार्य का एक अव्यवस्था है।
ग्राम-नकारात्मक बैक्टीरिया निष्क्रिय होते हैं और लाइसोसोम एंजाइम द्वारा पचते हैं। पूरक प्रतिरक्षा प्रतिक्रिया को पूरा करता है, रोगाणुओं (बैक्टीरिया, स्पाइरोकेट्स, ट्रिपैनोसोम) का एक लसीका पैदा करता है, भड़काऊ प्रतिक्रिया के विकास को सक्रिय करता है, फेगोसाइटोसिस और इंट्रासेल्युलर पाचन को बढ़ावा देता है।
Phylogenesis की प्रक्रिया में, इम्यूनोग्लोबुलिन के साथ एक साथ पूरक दिखाई दिया। पक्षियों से प्राप्त एंटीबॉडी स्तनधारी पूरक पर कब्जा नहीं करते हैं। उदाहरण के लिए, चिक इम्यून सीरम खरगोशों, गिनी सूअरों या चूहों से पूरक को सक्रिय नहीं करता है।
I के प्राकृतिक कारकों में तथाकथित शामिल हैं। सामान्य एंटीबॉडी, जिसकी उपस्थिति, जाहिरा तौर पर, रोग के पिछले टीकाकरण या संचरण से जुड़ी नहीं है। विभिन्न जीवाणुओं के खिलाफ मानव और पशु सीरा में सामान्य एंटीबॉडी पाए गए: स्टैफिलोकोकी, टाइफाइड बुखार के प्रेरक एजेंट, पेचिश, एंथ्रेक्स, हैजा, आदि। इम्यून वालों के विपरीत सामान्य एंटीबॉडीज का टिटर कम होता है, और उनकी एविएडिटी (एविएडिटी देखें) कम स्पष्ट होती है। । सामान्य एंटीबॉडी की विशिष्टता प्रतिरक्षा एंटीबॉडी से भिन्न नहीं होती है और बहुत अधिक हो सकती है। सामान्य एंटीबॉडी, जैसे प्रतिरक्षा एंटीबॉडी, एंटीजन (जैसे बैक्टीरिया) से बंधते हैं, पूरक की उपस्थिति में उनके एग्लूटीनेशन और लसीका का कारण बनते हैं, उन्हें opsonize करते हैं, फेगोसाइटोसिस को बढ़ावा देते हैं, विषाक्त पदार्थों, वायरस को बेअसर करते हैं।
सामान्य एंटीबॉडी, अर्थात्, रोगाणुओं और अन्य रोगजनक एजेंटों के खिलाफ शरीर की प्राकृतिक रक्षा का कार्य करते हैं जिनमें विदेशी एंटीजन गुण होते हैं। युवा जानवरों में, सामान्य एंटीबॉडी वयस्कों की तुलना में कम होती हैं, और भ्रूण और नवजात शिशुओं में वे अक्सर अनुपस्थित होते हैं। रोगाणुओं के लिए एंटीबॉडी के अलावा, मानव रक्त सीरम में खरगोश, चूहे, सुअर, राम, आदि के साथ-साथ मानव लाल रक्त कोशिकाओं के लिए एंटी-ए और एंटी-बी आइसोएंटिबॉडी के एरिथ्रोसाइट्स के लिए सामान्य हेटेरोएंटिबॉडी होते हैं।
सामान्य एंटीबॉडी के कारण अभी भी स्पष्ट नहीं हैं। उनकी उत्पत्ति की दो परिकल्पनाएँ हैं। L. Hirschfeld (1928) द्वारा प्रस्तावित परिकल्पना के अनुसार, शरीर में सामान्य आइसोएंटीबॉडीज टीकाकरण प्रक्रियाओं की परवाह किए बिना उत्पन्न होती हैं। कोशिकाओं की क्षमता सामान्य आइसोएंटीबॉडी का उत्पादन करने के लिए आनुवंशिक लक्षणों से निर्धारित होती है। इन वर्णों का फ़िऑलोजेनेसिस और उनका ओटोजेनेटिक विकास शारीरिक विशेषताओं के विकास के समान कानूनों का पालन करते हैं। मॉर्फोजेनेसिस के साथ समानता से, एल। हिर्स्चफेल्ड ने "सेरोजेनेसिस" की अवधारणा पेश की। मॉर्फोल के साथ, शरीर में विभेदन होता है और सेरोल, विभेदीकरण, धार उम्र पर निर्भर करता है। सामान्य एंटीबॉडी का गठन, जैसा कि एल। हिर्शफेल्ड द्वारा सुझाया गया है, एक "सहज", परिपक्व और विकासशील कोशिकाओं का एंटीजन-स्वतंत्र कार्य है। इसका एक उदाहरण उन निवासियों में डिप्थीरिया विष के एंटीबॉडी का उद्भव है जहां डिप्थीरिया रोग आमतौर पर नहीं पाए जाते हैं, लेकिन 17 साल की उम्र तक एंटीटॉक्सिक एंटीबॉडी वयस्क स्तर तक पहुंच जाते हैं।
सामान्य एंटीबॉडीज की उत्पत्ति की आनुवंशिक प्रकृति को देखते हुए, एल। हिर्शफेल्ड ने सुझाव दिया कि सामान्य एंटीबॉडी "संक्रामक रोगों से पीड़ित मानव के लंबे इतिहास" के परिणामस्वरूप उत्पन्न हुई, जो पर्यावरण के साथ एक व्यक्ति के निकट और लंबे समय तक संपर्क है। फ़्लेगोजेनेसिस के दौरान प्रजातियों के जीवित रहने में योगदान देने वाली प्रतिरक्षा प्रतिक्रियाएं चयन द्वारा निर्धारित की गईं और विरासत में मिलीं। भविष्य में, शरीर की कोशिकाओं ने एंटीजन के संपर्क की परवाह किए बिना एंटीबॉडी का उत्पादन करने की क्षमता हासिल कर ली। यह क्षमता केवल कोशिकाओं की आनुवंशिक विशेषताओं पर निर्भर करना शुरू हुई जो एंटीबॉडी बनाती हैं।
आई। के प्राकृतिक कारकों में इंटरफेरॉन (देखें), इसहाक और लिंडेनमैन (ए। इसाक, जे। लिंडमैन, 1957) द्वारा खोजा गया है। यह ज्ञात था कि एक संक्रमण दूसरे के विकास को रोक सकता है। उदाहरण के लिए, चेचक के टीके को 9-15 दिनों तक बच्चों में टीका नहीं लगाया गया था, क्योंकि वे जीवित खसरे के टीके के साथ टीका लगाए गए थे। एक जीवित पोलियो वैक्सीन का टीकाकरण फ्लू के लिए एक अल्पकालिक आई बनाता है। दूसरों के विकास पर कुछ वायरस के निरोधात्मक प्रभाव को हस्तक्षेप की घटना कहा जाता है। यह घटना, जैसा कि उपरोक्त लेखकों ने दिखाया है, संक्रमित कोशिकाओं द्वारा उत्पादित एक विशेष प्रोटीन पर निर्भर करता है - इंटरफेरॉन।
इंटरफेरॉन अतिसंवेदनशील कोशिकाओं की संख्या को सीमित करता है, जिससे संक्रमण बंद हो जाता है। यह इन्फ्लूएंजा और अन्य तीव्र वायरल संक्रमणों की अपेक्षाकृत तेजी से राहत, तेजी से ठीक होने की शुरुआत की व्याख्या करता है। इंटरफेरॉन की सबसे बड़ी प्रभावशीलता इसके रोगनिरोधी उपयोग में प्रकट होती है। हालाँकि, चिह्नित और लेट गया। कुछ वायरल संक्रमणों में इंटरफेरॉन का प्रभाव।
हस्तक्षेप की घटना न केवल वायरस के बीच होती है, बल्कि बैक्टीरिया और अन्य रोगाणुओं के बीच भी होती है।
यह ज्ञात है कि सामान्य आंतों के वनस्पतियों में कुछ रोगजनक बैक्टीरिया पर एक विरोधी प्रभाव हो सकता है। उदाहरण के लिए, ई। कोलाई स्ट्रेप्टोकोकस, स्टेफिलोकोकस, टाइफाइड बुखार और पेचिश के प्रेरक एजेंटों का एक विरोधी है। कुछ बैक्टीरिया जीवाणुनाशक पदार्थ पैदा करते हैं जो अन्य जीवाणुओं पर कार्य करते हैं, जो रोगजनक रोगाणुओं के शरीर के प्रतिरोध में योगदान करते हैं। एंटीबायोटिक दवाओं या विकिरण के उपयोग से सामान्य वनस्पतियों की संरचना में बदलाव हो सकता है और इसके द्वारा शरीर के सुरक्षात्मक रूप से स्थापित सुरक्षात्मक कार्य के कारण नुकसान हो सकता है जो रोगजनक एजेंटों को बेतरतीब ढंग से प्रवेश करने के संबंध में है।
phagocytosis
शरीर की सबसे महत्वपूर्ण सुरक्षात्मक प्रतिक्रियाओं में जो वंशानुगत और अधिग्रहित I में महत्वपूर्ण हैं, सूजन और फागोसाइटोसिस हैं। इंजेक्शन स्थल पर सूक्ष्मजीवों को गुणा करना शुरू होता है, शरीर के लिए विषाक्त पदार्थ उत्पन्न होते हैं, जिससे कोशिका क्षति होती है। शरीर के किनारे से प्रतिक्रिया सुरक्षात्मक प्रतिक्रिया के रूप में, प्रवेशित रोगाणुओं (सूजन देखें) के आसपास एक स्थानीय भड़काऊ ध्यान केंद्रित किया जाता है। परिवर्तित केशिका दीवारों के माध्यम से, बहुरूपक-परमाणु ग्रैन्यूलोसाइट्स यहां प्रवेश करते हैं। भड़काऊ फोकस में, तापमान बढ़ जाता है, एसिडोसिस और हाइपोक्सिया होते हैं, जो वायरस पर हानिकारक प्रभाव डालते हैं। रोगाणुओं को निष्क्रिय करने से रक्त, पूरक, ऑप्सिन, लाइसोजाइम, ल्यूकिंस, बीटा-लाइसिन और वायरल इनहिबिटर से सामान्य और प्रतिरक्षा एंटीबॉडी के प्रवेश की सुविधा मिलती है। श्वेत रक्त कोशिकाएं एक प्रकार का शाफ्ट बनाती हैं जो रोगाणुओं के प्रसार को रोकती हैं। यह फाइब्रिन के साथ इंटरसेलुलर स्पेस के ब्लॉकेज में योगदान देता है। ग्रैनुलोसाइट्स और मैक्रोफेज की फागोसाइटिक गतिविधि, दोनों रक्त प्रवाह से आ रही हैं, और स्थानीय, स्थानीय भड़काऊ फोकस में संक्रमण के परिणाम पर एक निर्णायक प्रभाव है।
I. में फ़ैगोसाइटिक प्रतिक्रिया का महत्व I I. मेचनिकोव के शास्त्रीय अध्ययन द्वारा उचित था।
विकासवादी सीढ़ी के विभिन्न चरणों में फागोसाइटोसिस की भूमिका का अध्ययन - एककोशिकीय से उच्चतर जानवरों तक - इस विचार की शुद्धता की पूरी तरह से पुष्टि की, जिसे प्रतिरक्षा के फागोसाइटिक सिद्धांत कहा जाता था। दुनिया भर के कई देशों में किए गए कई प्रायोगिक अध्ययनों ने इस सिद्धांत के मूल सिद्धांत को हिला नहीं दिया है। इसके विपरीत, सिद्धांत को नए तथ्यों द्वारा प्रबलित किया गया, सार्वभौमिक रूप से मान्यता प्राप्त हुई और दृढ़ता से विश्व विज्ञान के स्वर्ण कोष में प्रवेश किया। दो प्रणालियों की कोशिकाएं फागोसाइटोसिस प्रतिक्रिया में भाग लेती हैं: माइक्रोफेज और मैक्रोफेज। माइक्रोफेज में ग्रैनुलोसाइट्स (बेसोफिल, न्यूट्रोफिल, ईोसिनोफिल) शामिल हैं, जो सूजन के फोकस में प्रवेश करने वाले पहले हैं। मैक्रोफेज (देखें) में मोनोसाइट्स शामिल होते हैं जो परिसंचारी रक्त से संक्रमित या क्षतिग्रस्त ऊतकों में प्रवेश करते हैं, जहां वे बस जाते हैं, साथ ही यकृत में स्थाई मैक्रोफेज - स्टेलेट एंडोथेलियोसाइट्स (कुफ़्फ़र कोशिकाएं), तिल्ली, लिम्फ, नोड्स, थाइमस, मैक्सिमोव की साहसिक कोशिकाएं; संयोजी ऊतक हिस्टियोसाइट्स। ग्रैनुलोसाइट्स अस्थि मज्जा कोशिकाओं से आते हैं। परिपक्वता की प्रक्रिया में, वे दो प्रकार के दानों में दिखाई देते हैं: बड़ा, प्राथमिक, या लाइसोसोम जिसमें पाचन एंजाइम, एसिड हाइड्रॉलिसिस, मायलोपरोक्सीडेज, जीवाणुनाशक प्रोटीन और छोटे माध्यमिक दाने होते हैं, जो एंजाइम में खराब होते हैं, लेकिन फिर भी क्षारीय फॉस्फेट होते हैं, लाइसोजाइम और लैक्टोफेरिन - जीवाणुनाशक गुणों वाले पदार्थ। ऊतकों में 6-7 घंटे से अधिक नहीं, जहां वे प्रवेश करते हैं और जहां एचएल प्रकट होता है, वहां माइक्रोप्रेजेज 6-7 घंटे से अधिक समय तक रक्त प्रवाह में प्रसारित होते हैं। आगमन। उनकी फ़ैगोसाइटिक गतिविधि, वे 4-5 दिनों तक व्यवहार्य रहती हैं। मोनोसाइट्स रक्तप्रवाह में 3 दिनों तक फैलते हैं, अर्थात् ग्रैनुलोसाइट्स की तुलना में लंबे समय तक, और ऊतकों में घुसना, वे स्थानीय मैक्रोफेज बन जाते हैं, एक से कई महीनों तक उनकी व्यवहार्यता बनाए रखते हैं। मोनोसाइट्स और मैक्रोफेज सामान्य परिस्थितियों में विभाजित नहीं होते हैं, उनके पास एसिड हाइड्रॉलिस युक्त प्राथमिक और माध्यमिक लाइसोसोम हैं; पेरोक्सीडेस भी मोनोसाइट्स के प्राथमिक लाइसोसोम में स्थित है। फागोसाइटिक लाइसोसोम में 25 से अधिक विभिन्न प्रोटियोलिटिक और हाइड्रोलाइटिक एंजाइम पाए गए।
फागोसाइटोसिस प्रतिक्रिया में, कई चरणों को प्रतिष्ठित किया जाता है: माइक्रोब के लिए फागोसाइट की आसक्ति, इसके अवशोषण, लाइसोसोम के साथ फागोसोम और संलयन का गठन, सूक्ष्म जीव के इंट्रासेल्युलर निष्क्रियता, इसके एंजाइमी पाचन और शेष अक्षत सामग्री को हटाने।
फागोसिटिक सेल की बाहरी झिल्ली, जिसमें माइक्रोब शामिल हो गया है, सूज जाता है, कलियों और एक फागोसोम बनाता है। लाइसोसोमल ग्रैन्यूल्स के साथ उत्तरार्द्ध विलय हो जाता है, एक फालगोलिसोम का गठन होता है, और जीवाणुनाशक गुणों वाले विभिन्न एंजाइम और अन्य प्रोटीन इसमें प्रवेश करने लगते हैं, जिससे सूक्ष्म जीवों की निष्क्रियता होती है, इसके मैक्रोलेक्युलस का क्षरण होता है। मैक्रोफेज में इंट्रासेल्युलर पाचन के बाद, छोटे अणुओं को सेल से छोड़ा जा सकता है, जबकि बड़े अणु और अपच सामग्री द्वितीयक लाइसोसोम में रहती है। अल्पकालिक कोशिकाओं के रूप में ग्रैनुलोसाइट्स अपचनीय सामग्री के भंडारण में भाग नहीं लेते हैं।
हालांकि, ऐसे कारक हैं जो फ़ैगोसाइटिक प्रक्रिया को सक्रिय कर सकते हैं। उनमें से एक - ओप्सिनिन्स (देखें), 1903 में ए। राइट और डगलस (एस डगलस) द्वारा खोजा गया, सामान्य सीरम पदार्थ हैं जो रोगाणुओं के सीधे संपर्क में आते हैं, जिससे उत्तरार्द्ध फेगोसाइटोसिस के लिए अधिक सुलभ हो जाता है। सामान्य और विशेष रूप से प्रतिरक्षा सूक्ष्मजीवविज्ञानी एंटीबॉडी एक opsonizing प्रभाव है।
लिम्फोसाइटों द्वारा निर्मित ओप्सोनिन और केमोटैक्टिक कारकों की खोज ने सेलुलर और हास्य कारकों के बीच घनिष्ठ संबंध स्थापित करने में बड़ी भूमिका निभाई। टी-लिम्फोसाइट्स एक विशिष्ट एंटीजन रिलीज विभिन्न फार्माकोलॉजिकली सक्रिय पदार्थों (लिम्फोसाइट्स) के लिए संवेदी है जिसमें फागोसाइट्स के लिए केमोटैक्टिक गुण होते हैं। ये पदार्थ संक्रमण कोशिकाओं, विशेष रूप से मोनोन्यूक्लियर कोशिकाओं, को संक्रमण के फोकस में और उनके माइक्रोबायोटिक गुणों को बढ़ाने में मदद करते हैं। मैक्रोफेज की संस्कृति, जिसमें से टी-कोशिकाओं को बाहर रखा गया था, ने कुष्ठ रोग के प्रेरक एजेंट को नहीं छोड़ा। लिम्फोसाइटों के अलावा कुष्ठरोग से ग्रस्त व्यक्तियों के कुष्ठ रोग के रूप में फैग्रोसाइटाइज्ड रोगाणुओं के लिए नेतृत्व करने वाले कुष्ठ रोग का कारण बनता है।
सक्रिय मैक्रोफेज चयापचय गतिविधि को बढ़ाते हैं, वे तेजी से और अधिक सक्रिय रूप से फैलते हैं और रोगाणुओं को पकड़ते हैं, उनमें हाइड्रॉलिसिस की मात्रा अधिक होती है। प्लास्मिनोजेन, एक ट्रिप्सिन जैसा एंजाइम जो भड़काऊ प्रतिक्रिया में शामिल है, सक्रिय मैक्रोफेज से जारी किया जाता है।
लिम्फोसाइट्स ऐसे पदार्थों का भी उत्पादन करते हैं जो मैक्रोफेज के प्रवास को रोकते हैं, अर्थात्, मध्यस्थ मौजूद हैं जो मैक्रोफेज पर उत्तेजक और अवरोधक दोनों प्रभाव डालते हैं। यह देखा जाना बाकी है कि क्या टी-लिम्फोसाइट्स द्वारा सक्रिय मैक्रोफेज अन्य विधियों द्वारा सक्रिय मैक्रोफेज से काफी भिन्न होता है। जीनस साल्मोनेला, ब्रुसेला के जीवाणुओं से प्रतिरक्षित पशुओं से प्राप्त मैक्रोफेज में इंट्रासेल्युलर रूप से संबंधित रोगाणुओं को निष्क्रिय करने की क्षमता अधिक होती है।
रोगाणु, सामान्य और प्रतिरक्षा ग्लोब्युलिन को रोगाणुओं के अलावा सतह की विद्युत क्षमता को कम कर देता है और इस तरह से फागोसाइट और अवशोषण की सतह पर उनके सोखने में योगदान देता है। हालांकि, फागोसाइटोसिस पर एंटीबॉडी का सक्रिय प्रभाव केवल इसी तक सीमित नहीं है। एंटीबॉडीज जो एक्सोटॉक्सिन और एंडोटॉक्सिन, साथ ही माइक्रोबियल एंजाइमों को बेअसर करते हैं, एंटीजन-एंटीबॉडी परिसरों के इंट्रासेल्युलर पाचन में योगदान करते हैं। पूरक की उपस्थिति में ओप्सिन की गतिविधि बढ़ जाती है। बैक्टीरिया के ऑप्सनाइजेशन में अग्रणी भूमिका IgG और Sz की है।
फागोसाइटोसिस की प्रतिक्रिया में प्लेटलेट्स भी भाग लेते हैं। वे केमोटैक्सिस को प्रभावित करते हैं, बैक्टीरिया, स्पाइरोकेट्स, ट्रिपैनोसोम के साथ समुच्चय बनाते हैं और जिससे फागोसिटोसिस में योगदान होता है। फागोसाइटोसिस की प्रतिक्रिया में, एक सी-प्रतिक्रियाशील प्रोटीन भी भाग लेता है। बैक्टीरिया की सतहों के साथ बातचीत, यह फागोसाइटोसिस को तेज करता है, ल्यूकोसाइट्स के प्रवास को उत्तेजित करता है, और उनके ब्लास्ट्रोसाइट्स को प्रेरित करता है। सी-रिएक्टिव प्रोटीन को बदलकर या नेक्रोटिक कोशिकाओं पर सूजन वाले स्थानों पर जमा किया जाता है, और सेल झिल्ली की संरचनाओं के साथ निकटता से जुड़ा हुआ है।
लिम्फ, नोड्स, प्लीहा, यकृत, फेफड़े, अस्थि मज्जा, रक्त वाहिकाओं की आंतरिक दीवार और अन्य अंगों के फिक्स्ड मैक्रोफेज सबसे महत्वपूर्ण बाधा कार्य करते हैं। वे कीटाणुओं और उनके चयापचय उत्पादों से रक्त और लसीका को शुद्ध करते हैं। प्रतिरक्षा प्रणाली में, मैक्रोफेज का अवरोध कार्य काफी बढ़ जाता है। यह एंटीबॉडी के ऑप्सोनाइजिंग फ़ंक्शन पर और प्रतिरक्षा प्रणाली में खुद फागोसाइट्स की गतिविधि में वृद्धि पर निर्भर करता है। मैक्रोफेज सबसे महत्वपूर्ण कारक हैं जो वायरस से रक्त की निकासी सुनिश्चित करते हैं, वे वायरल कॉर्पोराइट्स पर कब्जा करते हैं और पचते हैं। मैक्रोफेज विशेष रूप से विशिष्ट एंटीबॉडी की उपस्थिति में सक्रिय होते हैं जो वायरस को खोलते हैं और जिससे फैगोसाइटोसिस और वायरस के विघटन की प्रक्रिया में योगदान होता है। मैक्रोफेज की गतिविधि पशु के आनुवंशिक गुणों और इसके पोषण की उपयोगिता पर निर्भर करती है। जानवरों में सामान्य-प्रोटीन वाले खाद्य पदार्थ खिलाए गए, ल्यूकोसाइट फागोसाइटिक गतिविधि प्रोटीन-मुक्त या कम-प्रोटीन आहार वाले जानवरों की तुलना में अधिक थी।
पार करने से, खरगोशों की संतानों को प्राप्त करना संभव है जो उच्च प्रतिरोधी और तपेदिक के प्रति अत्यधिक संवेदनशील हैं। प्रतिरोधी जानवरों से मैक्रोफेज में अधिक लाइसोसोम होते थे, और उनके हाइड्रोलाइटिक एंजाइम की गतिविधि अधिक थी।
उम्र के साथ संक्रमण के लिए मैक्रोफेज का प्रतिरोध। वयस्क मैक्रोफेज के विपरीत युवा जानवरों से संक्रमित मैक्रोफेज वायरस के वाहक हो सकते हैं। प्रतिरक्षा चूहों से प्राप्त मैक्रोफेज में, इन्फ्लूएंजा वायरस गुणा नहीं करता है और इस वायरस के प्रतिजन को केवल कई घंटों तक एकल कोशिकाओं में पता लगाया जा सकता है, जबकि गैर-प्रतिरक्षा मैक्रोफेज में यह कई दिनों तक बना रहता है।
सामान्य शारीरिक कारक और प्रतिरक्षा के तंत्र। सामान्य शारीरिक कारक और तंत्र प्रतिरक्षा के गठन में एक बड़ा हिस्सा लेते हैं। स्थानीय भड़काऊ फोकस में तापमान बढ़ाने के अलावा, हीलिंग प्रक्रिया के लिए बुखार कम महत्वपूर्ण नहीं है। ए। ए स्मोरोडिंटसेव ए (1955) और ए लवॉव (1962) के अनुसार, वायरल संक्रमण से उबरने की प्रक्रिया में बुखार मुख्य कारक है। वायरस और अन्य रोगाणुओं पर ऊंचे तापमान की कार्रवाई के तंत्र का सवाल खराब समझा जाता है। क्या इसका रोगाणुओं पर सीधा प्रभाव पड़ता है या क्या इसका प्रभाव अप्रत्यक्ष है, इसका अध्ययन किया जाना बाकी है। यह नहीं भूलना चाहिए कि शरीर के तापमान में वृद्धि के साथ, इम्यूनोजेनेसिस प्रक्रियाओं को तेज किया जाता है, चयापचय प्रक्रियाओं को तेज किया जाता है, जो वायरस और विषाक्त पदार्थों को निष्क्रिय करने में भी योगदान कर सकता है।
शरीर से पसीने के तरल पदार्थ, थूक, मल, मूत्र, और अन्य रहस्यों और अंशों के साथ वायरस, विषाक्त पदार्थों और अन्य माइक्रोबियल क्षय उत्पादों को अलग करना सामान्य फिजियोलॉजी में से एक माना जा सकता है। तंत्र I "अलगाव", एल ए ज़िलर और ए डी एडो की शब्दावली में, तंत्र शरीर के आंतरिक वातावरण के सापेक्ष कब्ज की अधिक तेजी से बहाली में योगदान देता है, संक्रमण द्वारा उल्लंघन किया जाता है।
जैसा कि पी। एफ। जेड्रोडोव्स्की और उनके सहयोगियों के अध्ययन से पता चला है, विशिष्ट और निरर्थक कारक और तंत्र I के शरीर के न्यूरोहोर्मोनियल कार्यों के विनियामक प्रभाव के तहत हैं।
ग्लूकोकार्टिकोआड्स की बड़ी खुराक भड़काऊ प्रतिक्रिया को कम करती है, फ़ागोसाइट्स के प्रवेश को फोकस में कम करती है। हाइड्रोकार्बन की कार्रवाई के तहत रोगाणुओं के अंतिम कब्जे और उनके पाचन में काफी कमी आई है, हाइड्रोकार्टिसोन लाइसोसोम झिल्ली को स्थिर करता है और इस प्रकार उनसे विभिन्न हाइड्रोलाइटिक एंजाइमों की प्राप्ति को रोकता है। छोटे फ़िज़िओल, हाइड्रोकार्टिसोन की खुराक शरीर के संक्रमण के प्रतिरोध में योगदान करती है।
एड्रेनोकोर्टिकोट्रोपिक हार्मोन नाटकीय रूप से पोलियो वायरस, और चूहों को इन्फ्लूएंजा वायरस की प्राकृतिक प्रतिरक्षा को कमजोर करता है। हाइड्रोकार्टिसोन के प्रभाव के तहत, वयस्क चूहों को नवजात शिशुओं के रूप में कॉक्ससेकी वायरस के लिए अतिसंवेदनशील हो जाता है। लेटो के साथ ग्लुकोकोर्टिकोइड्स का उपयोग। लक्ष्य से तपेदिक का शमन हो सकता है, ऊतकों और थूक में बैक्टीरिया की संख्या में वृद्धि हो सकती है। कुछ संक्रमणों के खिलाफ शरीर की रक्षात्मक प्रतिक्रियाओं पर थायरॉयड, अग्न्याशय और गोनाड का हार्मोनल प्रभाव स्थापित किया गया है।
अधिग्रहित प्रतिरक्षा के कारक और तंत्र
संक्रमण के दौरान या टीकाकरण के बाद, एंटीजन की प्रतिक्रिया न केवल इम्युनोकोम्पेटेंट कोशिकाओं (देखें) और मैक्रोफेज में बदल जाती है। जैसा कि आई। एल। क्रिचेव्स्की और उनके सहयोगियों के अध्ययन से पता चला है कि जानवरों की चिकनी पेशी कोशिकाएँ ब्रूसीलोसिस या टाइफाइड एंडोटॉक्सिन से प्रतिरक्षित होती हैं, इन एंटीजन के लिए प्रतिरक्षा बन जाती हैं। चिकनी मांसपेशियों की कोशिकाओं के क्षेत्र की स्थिति विशिष्ट है और सेंट बनी रहती है 2 महीने इस घटना का तंत्र अभी भी अच्छी तरह से समझा नहीं गया है। यह एंटीबॉडी पर निर्भर नहीं करता है, क्योंकि अन्य जानवरों के लिए प्रतिरक्षा का निष्क्रिय हस्तांतरण विफल हो जाता है। जाहिर है, यह घटना कोशिकाओं के एक विशिष्ट प्रतिरक्षा पुनर्व्यवस्था का परिणाम है।
टीकाकरण के दौरान फागोसाइटिक कोशिकाओं के विशिष्ट पुनर्व्यवस्था के सवाल का अभी तक स्पष्ट जवाब नहीं मिला है। कुछ शोधकर्ताओं ने प्रतिरक्षा जानवरों से प्राप्त फागोसाइट्स की वृद्धि की गतिविधि को एंटीबॉडी के ओप्पोइज़िंग प्रभाव के लिए जिम्मेदार ठहराया, जबकि अन्य ने इस घटना को स्वयं फागोसिटिक कोशिकाओं के एक विशिष्ट पुनर्गठन के परिणामस्वरूप माना।
इम्यून मैक्रोफेज में अधिक अम्लीय हाइड्रॉलिस होते हैं, उनका पाचन, श्वसन और माइटोटिक गतिविधि सामान्य जानवरों से मैक्रोफेज की तुलना में अधिक होती है।
जन्मजात प्रतिरक्षा प्रदान करने वाले गैर-विशिष्ट तंत्रों के विपरीत, एंटीबॉडी (देखें) अधिग्रहित विशिष्ट का एक कारक हैं और वे एक प्राकृतिक संक्रमण या कृत्रिम टीकाकरण के परिणामस्वरूप दिखाई देते हैं। बैक्टीरिया, वायरस, विषाक्त पदार्थों और अन्य विदेशी एंटीजन के लिए एक विशिष्ट प्रतिरक्षा प्रतिक्रिया इम्यूनोकोम्पेटेंट कोशिकाओं - टी-, बी-लिम्फोसाइट्स और मैक्रोफेज (इम। इम्यूनोकोम्पेंट सेल, मैक्रोफेज) द्वारा की जाती है। प्रतिरक्षा प्रतिक्रिया में इन तीन प्रकार की कोशिकाओं की भागीदारी और उनके करीबी कार्यात्मक संबंध संदेह में नहीं हैं। हालांकि, I के गठन की प्रक्रिया में उनके बीच संबंधों के विशिष्ट तंत्र अपर्याप्त रूप से अध्ययन किए गए हैं।
थाइमस ग्रंथि से उत्पन्न टी-लिम्फोसाइट्स के साथ एंटीजन की बातचीत (देखें) उनकी वृद्धि और विभाजन की ओर ले जाती है, जिसके परिणामस्वरूप विशेष रूप से संवेदी लिम्फोसाइटों की संख्या बढ़ जाती है। अधिकांश एंटीजन (टी-निर्भर) के लिए एंटीबॉडी के इष्टतम उत्पादन के लिए, टी- और बी-लिम्फोसाइटों के बीच एक सहकारी बातचीत की आवश्यकता होती है। हालांकि, ऐसे एंटीजन होते हैं जिनमें पुनरावृत्त सब्यूटिट्स होते हैं, जैसे न्यूमोकॉकल पॉलीसेकेराइड, बैक्टीरियल लिपोपॉलीसेकेराइड, पॉलीमराइज्ड फ्लैगेलिन, पॉलीविनाइलप्रायरोलाइडोन, जो टी कोशिकाओं के सहायक कार्य की अनुपस्थिति में प्लाज्मा कोशिकाओं द्वारा एंटीबॉडी के उत्पादन को उत्तेजित कर सकते हैं - जैसे। कहा जाता है। टी-स्वतंत्र एंटीजन। उनके लिए प्रतिरक्षा प्रतिक्रिया आईजीएम वर्ग के एंटीबॉडी के उत्पादन तक सीमित है, और इन प्रतिजनों के लिए इम्यूनोल, मेमोरी कोशिकाओं का निर्माण नहीं होता है। हालाँकि, ब्रेल-मुलेन (H. Braley-Mullen, 1974) के अध्ययन से पता चला कि राम एरिथ्रोसाइट्स में न्यूमोकोकल पॉलीसेकेराइड के अतिरिक्त इस जटिल एंटीजन को आईजीजी वर्ग के पॉलीसैकराइड-विशिष्ट एंटीबॉडी के गठन और इम्यूनोल, चूहों में स्मृति के निर्माण की क्षमता देता है। पॉलीवलेंट एंटीजन भी सीधे बी-कोशिकाओं के साथ बातचीत कर सकते हैं, जिससे उनकी सतह पर स्थित रिसेप्टर्स के साथ कई बॉन्ड बन सकते हैं। यह स्थापित किया गया है कि इम्युनोकोम्पेटेंट कोशिकाओं का कार्य प्रतिरक्षा प्रतिक्रिया (इम्युनोरिएक्टिव जीन) के व्यक्तिगत रूप से प्रभावी जीन द्वारा निर्धारित किया जाता है, जो ऊतक संगतता जीन से निकटता से संबंधित हैं। प्रतिरक्षाविज्ञानी जीन के प्रभाव में, किसी भी विदेशी प्रतिजनों के शरीर की सेलुलर और हास्य संबंधी प्रतिक्रियाएं बनती हैं।
Immunocompetent कोशिकाओं के अध्ययन में महान सफलता इस तथ्य की स्थापना थी कि सेल झिल्ली की सतह पर स्थानीयकृत इम्युनोग्लोबुलिन अणुओं द्वारा टी, बी कोशिकाओं और मैक्रोफेज के बीच बातचीत को अंजाम दिया जाता है। इन इम्युनोग्लोबुलिन के संश्लेषण को इम्युनोएक्टिव जीन के एक जटिल द्वारा एन्कोड किया गया है। मिचिसन की परिकल्पना के अनुसार (एन। मिचिसन) एट अल। (1974), विशिष्ट रिसेप्टर्स (IgT) की मदद से टी-लिम्फोसाइट्स बी-लिम्फोसाइट्स के विपरीत वाहक (स्प्लिटर) की एंटीजेनिक संरचना को पहचानते हैं, जो अन्य रिसेप्टर्स होने पर, पूर्ण एंटीजन के एंटीजेनिक निर्धारकों को पहचानते हैं। एंटीजन-सक्रिय (प्रतिरक्षित) टी-लिम्फोसाइट्स विशिष्ट और निरर्थक दोनों प्रकार के पदार्थ पैदा करते हैं, जो कोशिका की सतह से निकलने पर मैक्रोफेज और बी-लिम्फोसाइटों के बीच सहकारी संपर्क प्रदान करते हैं।
विशिष्ट कारकों की प्रकृति अभी भी अच्छी तरह से समझ में नहीं आई है। जाहिर है, वे इम्युनोग्लोबुलिन और एंटीजन या एंटीजेनिक निर्धारकों के एक जटिल से मिलकर होते हैं। फेल्डमैन (एम। फेल्डमैन) एट अल की परिकल्पना के अनुसार। (1974), यह जटिल (IgT एंटीजन), मैक्रोफेज के साथ बातचीत करने के बाद, जो एंटीजेनिक निर्धारकों के एक प्रकार के कंडेनसर हैं, बी-लिम्फोसाइटों द्वारा एंटीबॉडी के उत्पादन को ट्रिगर करता है। मैक्रोफेज की सतह संरचनाओं के लिए इम्युनोग्लोबुलिन और एंटीजेनिक निर्धारक (विशिष्ट कारक) के परिसर के अलावा होता है, ताकि एंटीजेनिक निर्धारक स्वतंत्र रहें और बी-लिम्फोसाइट झिल्ली के रिसेप्टर संरचनाओं के साथ बातचीत कर सकें। प्रतिरक्षाविज्ञानी कोशिकाओं के साथ एंटीजन की सहकारी बातचीत के लिए अन्य परिकल्पनाएं हैं।
रसायन। एक निरर्थक कारक की कार्रवाई की प्रकृति और तंत्र भी खराब समझे जाते हैं। यह सुझाव दिया जाता है [पी। एडम्स, 1975] कि यह या तो एक इम्युनोग्लोबुलिन टुकड़ा या एक छोटा गैर-प्रोटीन अणु है जो बी लिम्फोसाइटों पर हार्मोनल या सहायक प्रभाव डालता है।
उत्तरार्द्ध छोटे अस्थि मज्जा लिम्फोसाइटों से आते हैं, जिनमें से झिल्ली की सतह पर, प्लीहा और लिम्फ नोड्स में परिपक्वता के दौरान, इम्युनोग्लोबुलिन (आईजी) रिसेप्टर्स बनते हैं - एंटीबॉडी के अग्रदूत। एंटीजेनिक निर्धारकों की कार्रवाई के तहत, बी-लिम्फोसाइट्स सक्रिय हो जाते हैं, सक्रिय संश्लेषण और एंटीबॉडी के स्राव में सक्षम प्लाज्मा कोशिकाओं में विकसित होते हैं।
बर्नेट के क्लोनल चयन सिद्धांत (1971) के अनुसार, बी-लिम्फोसाइटों के प्रत्येक क्लोन का अपना विशिष्ट इम्युनोग्लोबुलिन रिसेप्टर है जो एक विशिष्ट एंटीजेनिक निर्धारक के साथ बातचीत कर सकता है। एंटीबॉडी का उत्पादन करने वाले अल्पकालिक प्लाज्मा कोशिकाओं के साथ, लंबे समय तक जीवित रहने वाले बी-लिम्फोसाइट्स हैं जो कि इम्युनोल, मेमोरी के कार्य को ले जाते हैं, क्रीमिया के कारण एनामेनेस्टिक प्रतिक्रिया होती है। टी, बी कोशिकाओं और मैक्रोफेज की पारस्परिक क्रिया प्रजनन केंद्रों के रोम में और प्लीहा के लाल गूदे में होती है। पी। मेदावर (१ ९ ५३) और एम। हसेक (१ ९ ५३) द्वारा वर्णित, एक विदेशी प्रतिजन के लिए शरीर की प्रतिक्रिया, जो भ्रूण काल \u200b\u200bमें इस प्रतिजन के परिचय के परिणामस्वरूप होता है, अंततः वायरस और बैक्टीरिया के लिए स्थापित नहीं किया गया है। यह नोट किया गया था कि जन्मजात वायरल संक्रमण के कारण, उदाहरण के लिए, चूहों में ग्रॉस वायरस या लिम्फोसाइटिक कोरियोनोमाइटिस द्वारा, इन वायरस के लिए मुफ्त एंटीबॉडी का पता नहीं लगाया जाता है या नगण्य मात्रा में होता है, जिसने इस घटना को सच इम्युनोल, टॉलरेंस की स्थिति के रूप में व्याख्या करने का कारण दिया। हालांकि, एक अधिक गहन अध्ययन से पता चला कि इन जन्मजात संक्रमणों के साथ भी, एंटीबॉडी का गठन होता है, लेकिन वे Ch में पाए जाते हैं। आगमन। वायरस से जुड़े एक राज्य में और गुर्दे और संवहनी कोशिकाओं के झिल्ली पर एक एंटीजन-एंटीबॉडी परिसर के रूप में पता लगाया जाता है।
प्रतिरक्षा प्रतिक्रियाएं, दोनों सेलुलर और विनोदी, एंटीजन की बड़ी खुराक के दोहराया प्रशासन द्वारा कृत्रिम रूप से दबाए जा सकते हैं, जिसके परिणामस्वरूप कुछ समय के लिए प्रतिरक्षाविज्ञानी पक्षाघात सेट होता है (देखें। सहिष्णुता प्रतिरक्षाविहीन है)।
एंटीबॉडी उत्पादन प्रोटीन जैवसंश्लेषण के सामान्य नियमों के अधीन है और प्लाज्मा कोशिकाओं के राइबोसोम पर होता है। विशिष्ट इम्युनोग्लोबुलिन के संश्लेषण की कोडिंग डीएनए - सेल की आरएनए प्रणाली द्वारा की जाती है, जबकि एंटीजन, जाहिरा तौर पर, एक ट्रिगरिंग फ़ंक्शन करता है, लेकिन इम्युनोग्लोबुलिन अणु के गठन में एक प्रारंभिक भूमिका नहीं निभाता है। एक परिकल्पना है, एक कटौती के अनुसार प्रतिजन इसी क्लोन की कोशिकाओं में एन्कोडेड आनुवंशिक जानकारी का दमन का कारण बनता है।
एंटीबॉडी की विशिष्टता उनके सबसे महत्वपूर्ण गुणों में से एक है। एक प्रकार के सूक्ष्म जीवों के संबंध में एंटीबॉडी अन्य प्रकार के रोगाणुओं के साथ बातचीत नहीं करती हैं, यदि बाद वाले में एंटीजेनिक निर्धारक नहीं होते हैं। आम एंटीजन की उपस्थिति क्रॉस-रिएक्शन का कारण बनती है। एक एंटीजन में कई एंटीजेनिक निर्धारकों की उपस्थिति कई प्रकार के एंटीबॉडी के गठन को उत्तेजित कर सकती है।
एंटीजन के प्रति कम संवेदनशील होने वाले एंटीबॉडी अणुओं में निर्धारकों की एंटीजेनिक संरचना के साथ कम पत्राचार होता है, जबकि अधिक एवीड अणु अधिक सटीक रूप से हप्टेन के स्थानिक विन्यास की आवश्यक विशेषताओं को पुन: पेश करते हैं (देखें)।
विशिष्ट इम्युनोग्लोबुलिन अधिग्रहीत humoral I के सबसे महत्वपूर्ण कारकों में से एक हैं। वे रोगाणुओं और उनके चयापचय उत्पादों - विषाक्त पदार्थों, एंजाइमों, साथ ही पशु और पौधों की उत्पत्ति के अन्य विदेशी एंटीजेनिक पदार्थों को बेअसर करते हैं। इम्युनोग्लोबुलिन का मूल्य, जिसके बीच 5 वर्ग प्रतिष्ठित हैं (आईजीएम, आईजीजी, आईजीए, आईजीडी, आईजीई), अधिग्रहित आई में अलग है। आईजीजी, आईजीए और आईजीएम द्वारा सबसे बड़ी भूमिका निभाई जाती है, जबकि आईजीडी और आईजीई का सुरक्षात्मक कार्य अपेक्षाकृत छोटा है। इसके अलावा, एलर्जी IgE से जुड़ी है। आईजीजी लगभग हैं। 70-80% सामान्य मानव इम्युनोग्लोबुलिन, और आईजीडी और आईजीई अपेक्षाकृत कम एकाग्रता में सीरम में हैं (देखें। इम्युनोग्लोबुलिन)।
एंटीबॉडी अणु का हिस्सा जहां सक्रिय केंद्र स्थित होता है, उसे फैब टुकड़ा कहा जाता है। केवल एक विशिष्ट एंटीजेनिक निर्धारक के साथ प्रतिक्रिया करने के लिए एक इम्युनोग्लोबुलिन अणु के सक्रिय केंद्र की क्षमता अमीनो एसिड की एक छोटी संख्या द्वारा गठित इसकी विशिष्ट तीन आयामी संरचना पर निर्भर करती है। विशिष्ट इंटरैक्शन एंटीबॉडी के सक्रिय केंद्र और एंटीजन के निर्धारक समूह की पारस्परिक स्थैतिक पूरक पर आधारित है। प्रतिजन और एंटीबॉडी काफी मजबूती से एक साथ वैन डेर वाल्स और हाइड्रोजन बलों द्वारा एक दूसरे से जुड़े हुए हैं। हालांकि, एंटीबॉडी के साथ एंटीजन का संयोजन अपरिवर्तनीय नहीं है। एंटीबॉडी द्वारा बेअसर विष को पूरी तरह से या आंशिक रूप से बहाल किया जा सकता है। इम्युनोग्लोबुलिन अणु के एक अन्य भाग द्वारा एक महत्वपूर्ण कार्य भी किया जाता है, जिसे एफसी टुकड़ा कहा जाता है। उत्तरार्द्ध एंटीबॉडी अणु को एक एंटीजन संलग्न करने के बाद पूरक (सी 1) को ठीक करने की क्षमता प्राप्त करता है। यह ध्यान में रखना चाहिए कि IgG अणु का Fc भाग प्रतिजन से स्वतंत्र होता है और इसमें स्टैफिलोकोकी (प्रोटीन A) और स्ट्रेप्टोकोकी [Stevens, Reed (C. Stephens, W. Reed, 1974) et al।] की कोशिका भित्ति और साथ ही साथ अभिकर्मकों के जोड़ भी होते हैं। (आईजीई) बेसोफिल और मास्ट कोशिकाओं के रिसेप्टर्स के लिए उनके अणुओं के एफसी-टुकड़े, जो एलर्जी के विकास में प्रारंभिक चरण है।
इम्युनोग्लोबुलिन घुलनशील एंटीजन के फैलाव की डिग्री को कम कर देते हैं, उनके वर्षा, प्रवाह, और कोर्पसुर्ल एंटीजन (वायरस, बैक्टीरिया, स्पाइरोक्रेट्स, प्रोटोजोआ) का कारण बनते हैं - एग्लूटिनेशन और एग्लोमरेशन। इम्युनोग्लोबुलिन और पूरक के परिसर, जो स्पाइरोकेट्स, ट्रिपैनोसोम्स और विब्रियोस, adsorb प्लेटलेट्स के झिल्ली पर तय होते हैं। लोडेड टी। रोगाणु कम मोबाइल, एग्लोमरेट हो जाते हैं, रक्त से तेजी से गायब हो जाते हैं, सक्रिय रूप से प्लीहा, लिम्फ, नोड्स और अन्य अंगों के लिम्फोइड ऊतक में सक्रिय होते हैं। एंटीबॉडी तटस्थ विष विषैले कोशिकाओं पर रिसेप्टर्स को बांधने की अपनी क्षमता खो देता है। बढ़े हुए कॉम्प्लेक्स (टॉक्सिन, एंटीटॉक्सिन, सप्लीमेंट) को बाधा वाले अंगों (लिम्फ, नोड्स, प्लीहा, यकृत, आदि) में देरी होती है और फागोसाइट्स का उद्देश्य बन जाता है। वायरस पर एंटीबॉडी का प्रभाव समान है। विशिष्ट एंटीबॉडी, वायरस के साथ संयोजन, उनके रिसेप्टर्स को अवरुद्ध करते हैं, भौतिक परिवर्तन करते हैं।-रसायन वायरन की सतह संरचनाओं के गुण, जिसके कारण वायरस एक संवेदनशील सेल में प्रवेश करने और उसमें प्रवेश करने की क्षमता खो देता है। शरीर में एंटीबॉडी का सुरक्षात्मक कार्य एक संवेदनशील सेल के रास्ते में वायरस को बेअसर करना है, उनके बीच संपर्कों को डिस्कनेक्ट करना है (एंटीवायरल प्रतिरक्षा देखें)।
एंटीबॉडी की बहुत कम मात्रा एक वायरल संक्रमण की घटना से बचा सकती है। केवल दो या चार एंटीबॉडी अणु, फेज प्रक्रिया के महत्वपूर्ण स्थलों में शामिल हो गए हैं, बाद वाले को बैक्टीरिया से जुड़ने से रोक सकते हैं। पूरक की भागीदारी के साथ, आईजीएम और आईजीजी बैक्टीरिया, स्पाइरोकेट्स, ट्रिपैनोसोम्स ले सकते हैं। लंबे समय तक वायरस के प्रतिरक्षा लसीका की संभावना का सवाल खुला रहा। एम। ए। मोरोज़ोव और एम। पी। कोरोलकोवा (1939) ने बताया कि एंटीबॉडीज संक्रामक गुणों के पूर्ण नुकसान के साथ चेचक के वायरस का कारण बन सकते हैं। 30 वर्षों के बाद, अल्मीडा और वाटरसन (जे। अल्मेडा, ए। वाटरसन, 1969) ने पक्षियों और रूबेला के संक्रामक ब्रोंकाइटिस के वायरस की प्रतिरक्षा लसीका पर सूचना दी। एंटीबॉडी और पूरक के साथ संवेदी पक्षियों के संक्रामक ब्रोंकाइटिस के वायरस में, एक इलेक्ट्रॉन माइक्रोस्कोप ने विषाणु के बाहरी रिम में वृद्धि और बाहरी गोले में "डेंट" की उपस्थिति दिखाई।
पूरक की एंजाइमैटिक कार्रवाई केवल तभी हो सकती है जब आईजी लिपोप्रोटीन युक्त झिल्ली में शामिल हो जाए।
ओरोसलान और गिलगिन (एस। ओरोसज़लान, आर। गिलगिन, 1970) के अध्ययन से पता चला है कि प्रतिरक्षा सीरम और पूरक के साथ माउस ल्यूकेमिया वायरस के उपचार से वायरस से समूह-विशिष्ट (जीएस) एंटीजन की रिहाई हुई, जबकि वायरस आरएनएएस में संवेदनशील हो गया, जिसने संकेत दिया। वायरसों के विनाश के बारे में। अलग से लिया गया, प्रतिरक्षा सीरम और पूरक इस तरह के परिवर्तन का कारण नहीं बने।
चिकन ट्यूमर वायरस में प्रतिरक्षा सीरम और पूरक के साथ प्रसंस्करण के परिणामस्वरूप परिवर्तन एक इलेक्ट्रॉन माइक्रोस्कोप के तहत Opua और Vigier (एम। Aupoix, पी। Vigier, 1975) द्वारा देखा गया। मॉर्फोल, परिवर्तन पूर्ववर्ती विरोलिसिस।
पूरक एंटीबॉडी की गतिविधि को प्रबल करता है, वायरस की निष्क्रियता को तेज करता है [हेनमैन (एच। हेनमैन), 1967]। प्राथमिक हर्पेटिक संक्रमण में शुरुआती एंटीबॉडी की गतिविधि पूरक पर निर्भर करती है। एक एंटीजन से जुड़े एंटीबॉडी के एफसी हिस्से के पूरक के अतिरिक्त वायरल रिसेप्टर्स के लिए अतिरिक्त स्टिकर बाधा पैदा करता है और इस तरह कम टिटर एंटीबॉडी का प्रभाव बढ़ जाता है, जो अकेले ही वायरस के साइटोट्रोपिक रिसेप्टर्स को आंशिक रूप से कवर कर सकता है। वयस्क सीरा की वायरस-बेअसर गतिविधि (बार-बार दाद के साथ) पूरक के अलावा 2-4 गुना बढ़ जाती है।
एंटीबॉडी की कार्रवाई के तहत विषाक्त पदार्थों, वायरस और अन्य रोगाणुओं से रक्त की शुद्धि (निकासी) में काफी तेजी आती है। जैसा कि शुल्त्स के अध्ययन से पता चलता है (आई। शुल्ट्ज़, 1966), सामान्य चूहों में, पोलियो वायरस के 10 ^ 7.5 TCPD50 के अंतःशिरा प्रशासन के एक घंटे बाद, वायरस के टिटर में थोड़ी कमी नोट की गई थी। प्रतिरक्षित चूहों में, 10 मिनट के बाद 5 lg से अधिक के वायरस टिटर में गिरावट देखी गई। सामान्य चूहों में वायरस के इंजेक्शन के एक घंटे बाद रक्त शुद्धि का सूचकांक 1.66 था, और प्रतिरक्षित चूहों में - 5 से अधिक।
वायरस पर एंटीबॉडी के opsonizing और agglutinating प्रभाव viremia के उन्मूलन के लिए मौलिक लगता है।
सभी के खिलाफ इम्युनोग्लोबुलिन के opsonizing प्रभाव, अपवाद के बिना, एंटीजन, दोनों घुलनशील और corpuscular, स्थापित किया गया है। एंटीबॉडी फागोसाइटोसिस की प्रक्रिया और विदेशी प्रतिजनों के विघटन में योगदान करती हैं। एंटीबॉडी द्वारा बेअसर, वे पचाने में आसान होते हैं। एंटीबॉडी का न केवल बैक्टीरिया, विषाक्त पदार्थों और वायरस पर, बल्कि स्पाइरोकेट्स, ट्रिपैनोसोम्स, मलेरिया, लिस्मेनिया, और टोक्सोप्लाज्मा के प्लास्मोडिया पर भी अधिक या कम विनाशकारी प्रभाव होता है। मलेरिया के लिए स्थानिकमारी वाले स्थानों में, उदाहरण के लिए, गाम्बिया में, बच्चे जीवन के पहले महीनों के दौरान मलेरिया के प्रति अपेक्षाकृत प्रतिरोधी पैदा होते हैं, जाहिर है अपनी मां से एंटीबॉडी के संचरण के कारण जो मलेरिया के प्लाज्मोडियम को बेअसर करते हैं। बाद में, 1 वर्ष से लेकर 5-8 वर्ष तक के बच्चों में इस बीमारी के होने की आशंका होती है। इम्युनोग्लोबुलिन के प्रभाव के तहत, स्पाइरोकैट्स के नए एंटीजेनिक वेरिएंट, एंटीबॉडी की पहली पीढ़ी के प्रतिरोधी ट्रिपैनोसोम उत्पन्न होते हैं, जो इन रोगाणुओं पर इम्युनोग्लोबुलिन के प्रत्यक्ष प्रभाव को भी इंगित करता है। इन्फ्लूएंजा वायरस के नए प्रतिजन वैरिएंट के उद्भव में एंटीबॉडी प्रमुख भूमिका निभाते हैं। ऐसे मामलों में जहां सूक्ष्मजीव (गोनोकोकी, ब्रुसेला, तपेदिक बैक्टीरिया, कुष्ठ और विशेष रूप से वायरस) स्थानीय रूप से इंट्रासेल्युलर होते हैं, एंटीबॉडी अप्रभावी होते हैं।
विभिन्न वर्गों के इम्युनोग्लोबुलिन के कार्यों में विशेषताएं हैं। आईजीएम (19 एस) एंटीजन प्रशासन के लिए शरीर की प्राथमिक प्रतिक्रिया के परिणामस्वरूप दिखाई देते हैं - प्रारंभिक एंटीबॉडी। 24-36 घंटों के बाद उनका पता लगाया जा सकता है। इन्फ्लूएंजा वायरस के चूहों को अंतःशिरा प्रशासन के बाद।
आईजीएम वर्ग के एंटीबॉडी का निर्धारण संक्रमण के प्रारंभिक निदान के लिए और यह निर्धारित करने के लिए किया जा सकता है कि यह मूल रूप से हुआ था। इस वर्ग के एंटीबॉडी संक्रमण के प्रारंभिक चरण में रोगजनक रोगाणुओं के बेअसर में शामिल हैं। वे बड़े कॉर्पसकुलर एंटीजन के खिलाफ अधिक सक्रिय हैं। एक खरगोश से प्राप्त मैक्रोग्लोबुलिन आईजीजी वर्ग के एंटीबॉडी की तुलना में मानव समूह ए एरिथ्रोसाइट्स की एग्लूटिनेशन प्रतिक्रिया में 750 गुना अधिक सक्रिय हैं। हैजा vibrios और Shigella Flexner के खिलाफ 198 एंटीबॉडी भी अधिक सक्रिय थे। कक्षा 7S एंटीबॉडी की तुलना में 19S एंटीबॉडी प्रति हेमोलिसिस प्रतिक्रिया में 100-1000 गुना अधिक सक्रिय हैं। आईजीएम वर्ग इम्युनोग्लोबुलिन इम्युनोग्लोबुलिन के अन्य सभी वर्गों की तुलना में अधिक सक्रिय हैं, पूरक संलग्न करते हैं। पूरक को एक आईजीएम अणु द्वारा भी सक्रिय किया जाता है, जबकि एक समान परिणाम प्राप्त करने के लिए कम से कम 20 आईजीजी अणुओं की आवश्यकता होती है। IgG वर्ग के एंटीबॉडी, जो सबसे महत्वपूर्ण सुरक्षात्मक कार्य के लिए जिम्मेदार हैं, बाद में 2 सप्ताह में IgM वर्ग के एंटीबॉडी की तुलना में बनते हैं। टीकाकरण की शुरुआत के बाद। लगभग। सक्रिय विशिष्ट सीरा के 70-80% इम्युनोग्लोबुलिन IgG के वर्ग के हैं। अन्य वर्गों के एंटीबॉडी की तुलना में इस वर्ग के एंटीबॉडी का बेहतर अध्ययन किया जाता है।
आईजीजी एंटीबॉडी विशेष रूप से पतले छितरी हुई एंटीजन को बेअसर करने में प्रभावी हैं: विष, वायरस। बार-बार संक्रमण या टीकाकरण के साथ, आईजीजी एंटीबॉडी इम्यूनोल कोशिकाओं की उपस्थिति के कारण जल्दी से उत्पन्न होते हैं, संबंधित एंटीजन को मेमोरी, जो माध्यमिक संक्रमण के संकेतक के रूप में काम कर सकते हैं। अपने छोटे आकार के कारण, आईजीजी अणु, नाल को मां से भ्रूण में प्रवेश कर सकते हैं और ट्रांसप्लासेंटल आई का कारण बन सकते हैं, जो जन्म के बाद कई महीनों तक बनी रहती है। एंटीबॉडीज की अम्लता, अर्थात्, प्रतिजन के साथ उनकी प्रतिक्रिया की गति और इसके साथ यौगिकों के गठन की ताकत, टीकाकरण के दौरान बढ़ जाती है। प्रारंभिक एंटीटॉक्सिक सीरा में बाद की तुलना में कम अवक्षेप होता है। एक ही सीरम में विभिन्न आबादी के एंटीबॉडी की कई आबादी हो सकती है। केवल सीरा बहुत जल्दी या इसके विपरीत लिया जाता है, बहुत देर से होता है, एक नियम के रूप में होता है, एक ही एविएटीटी के एंटीबॉडीज (एविएडिटी देखें)।
एक या किसी अन्य वर्ग के इम्युनोग्लोबुलिन का गठन न केवल अवधि पर निर्भर करता है; टीकाकरण, लेकिन एंटीजन के गुणों, इसकी खुराक, प्रशासन के मार्ग के साथ-साथ जानवरों के प्रकार और उम्र पर भी।
एंटीजन और उनके निर्धारकों की अधिक बाध्यकारी ताकत को बेअसर करने के लिए, एंटीबॉडी की वैधता महत्वपूर्ण है। द्विसंयोजक प्रतिपिंड अधिक सक्रिय होते हैं और उनकी एविएटी अधिक होती है, वे मोनोवालेंट की तुलना में कम सांद्रता में वायरस या बैक्टीरिया को बेअसर कर सकते हैं। ब्लिअंट एंटीबॉडीज, जैसा कि ब्लांक, लेस्ली (एस। ब्लैंक, जी। लेस्ली) एट अल द्वारा दिखाया गया है। (1972), मोनोवालेंट से 1000-2000 गुना बेहतर वायरस को बेअसर करता है। हालांकि, एंटीबॉडी की वैधता में वृद्धि और उनके निष्प्रभावी गतिविधि में वृद्धि के बीच कोई प्रत्यक्ष आनुपातिकता नहीं है। मोनोवालेंट एंटीबॉडी के परिसर में पृथक्करण की दर - प्रतिजन एंटीबॉडी के साथ एक ही एंटीजन के परिसर की तुलना में अधिक है। द्विसंयोजक प्रतिरक्षी अणुओं में, प्रतिजन के साथ यौगिक की ऊर्जा अधिक होती है, जो उनके कम पृथक्करण दर को समझाती है। यह माना जाता है कि [क्लिनमैन, लॉन्ग (एन। क्लिनमैन, सी। लॉन्ग) एट अल।, 1967] कि बाद में इम्यूनोग्लोब्युलिन के कार्य में सुधार के रूप में विकास के दौरान द्विध्रुवीय एंटीबॉडी उत्पन्न हुई, जिसने संक्रामक एजेंटों के खिलाफ शरीर की रक्षा में वृद्धि में योगदान दिया।
स्थानीय प्रतिरक्षा
आईजीए श्रेणी के एंटीबॉडी ने स्थानीय प्रतिरक्षा के गठन में उनके महत्व के बाद विशेष रूप से बहुत ध्यान आकर्षित किया है। शरीर में संक्रमण के लिए सबसे कमजोर स्थानों के अस्तित्व का विचार ए .19। 1919 में ए। बी। बेज़रज़ोय द्वारा व्यक्त किया गया था। इस प्रकार, त्वचा, उनकी राय में, एंथ्रेक्स के प्रेरक एजेंट के लिए एक स्थानीय नाबालिग प्रतिरोधक है, और आंत्र पथ - एंटरोबैक्टीरिया के लिए; रोगाणुओं के प्रति सबसे अधिक संवेदनशील ऊतकों के प्रतिरोध में वृद्धि सामान्य I के साथ होगी। स्थानीय और सामान्य I के बीच की अटूट कड़ी के बावजूद, परिकल्पना जिसने संक्रमण की शुरुआत और विकास के लिए स्थानीय विशिष्ट और निरर्थक कारकों के महत्व का दावा किया था उन्हें एक प्रयोगात्मक और पच्चर प्राप्त हुआ। पुष्टि।
श्वसन पथ के रहस्यों में मौजूद एंटीबॉडी, श्वसन वायरस से बचाने में महत्वपूर्ण भूमिका निभाते हैं। स्थानीय आई। समस्या का विकास इम्युनोग्लोबुलिन के नए वर्ग - आईजीए - और उनमें से स्रावी प्रकार के एंटीबॉडी की खोज द्वारा किया गया था। इन एंटीबॉडी को इस तथ्य के संबंध में उनका नाम मिला कि उन्हें श्वसन और ग्रंथियों के रहस्यों में रखा गया है। पथ, कोलोस्ट्रम और अन्य तरल पदार्थ प्लाज्मा की तुलना में बहुत अधिक एकाग्रता में। श्वासनली और ब्रोन्ची के श्लेष्म झिल्ली से वाशआउट में, IgA उनमें पाए जाने वाले प्रोटीन की कुल मात्रा का 53% बनाता है, जबकि IgG 15% से अधिक नहीं है। स्रावी IgA का उच्चतम स्तर मानव दूध में निर्धारित होता है। IgA वर्ग विषम है और इसमें एंटीबॉडी वेरिएंट शामिल हैं जो संरचना और आणविक गुणों में असमान हैं। इसलिए, उदाहरण के लिए, IgA में एक तिल होता है। वजन 160 एलएलसी और अवसादन निरंतर 7S। यह ch में निहित है। आगमन। सीरम में, और रहस्यों में - एक महत्वहीन राशि में। रहस्यों में, इसकी संरचना और गुणों में अद्वितीय एक इम्युनोग्लोबुलिन भी पाया जाता है, यह भी IgA वर्ग से संबंधित है, जो स्वयं स्रावी एंटीबॉडी का गठन करता है। वे डिमर्स और ट्रिमर के रूप में होते हैं, अर्थात्, उनके पास क्रमशः चार और छह वैधताएं हैं। मोल। मंद वजन लगभग। 400,000, और उच्चतर ट्रिमर। इन एंटीबॉडी का स्थिरीकरण स्थिरांक 11S - 14S - 18S है। स्रावी IgA अणु, डिमर और ट्रिमर दोनों में एक स्रावी घटक शामिल होता है - मोल के साथ एक ग्लाइकोप्रोटीन। वजन लगभग। 60,000 युक्त! लगभग। 9.5% कार्बोहाइड्रेट, सियालिक एसिड। ऐसा माना जाता है कि IgA अणु सहित स्रावी घटक, इसे स्थिर करता है, इंटरसेल्युलर स्पेस के माध्यम से पारगम्यता को बढ़ाता है और प्रोटिओलिटिक एंजाइमों के प्रतिरोध को बढ़ाता है, जो महत्वपूर्ण है क्योंकि इस प्रकार के एंटीबॉडी एंजाइमों से भरपूर वातावरण में स्थित और कार्य कर सकते हैं।
IgA (11S) के स्थानीय गठन के प्रमाण, और प्लाज्मा से इसके ट्रांसड्यूशन नहीं, यह है कि इंट्रानैसल टीकाकरण के बाद स्राव में इन एंटीबॉडी का टिटर सीरम की तुलना में अधिक हो सकता है।
स्रावी IgA के अणुओं को उप-उपकला ऊतकों में स्थानीय प्लाज्मा कोशिकाओं द्वारा संश्लेषित किया जाता है, और स्रावी घटक के साथ उनका संबंध होता है, जो ग्रंथि-आंत, श्वसन पथ, आदि के श्लेष्म झिल्ली के उपकला कोशिकाओं द्वारा निर्मित होता है, जब श्लेष्म झिल्ली की सतहों से गुजरता है। आईजीए के अलावा, आईजीजी और आईजीएम नाक स्राव में पाए जाते हैं, जो रक्त से छिड़काव द्वारा भी प्राप्त किया जा सकता है।
श्लेष्म झिल्ली की सतहों के माध्यम से शरीर में प्रवेश करने वाले रोगाणुओं से बचाने के लिए स्रावी एंटीबॉडी का बहुत महत्व है। स्थानीय I और स्रावी एंटीबॉडी की भूमिका उन संक्रमणों में विशेष रूप से महत्वपूर्ण है, जिनके लिए श्लेष्म झिल्ली की सतह प्रवेश द्वार और रोगज़नक़ के स्थानीयकरण स्थल दोनों हैं। और। कुछ संक्रमणों के लिए, उदाहरण के लिए, फ्लू के लिए, सीरम की तुलना में स्रावी एंटीबॉडी के साथ बेहतर संबंध रखता है। स्रावी एंटीबॉडी, सीरम एंटीबॉडी की तरह, वायरस, विषाक्त पदार्थों, बैक्टीरिया को बेअसर करने की क्षमता है। श्लेष्म झिल्ली की सतह पर उन्हें खोजना, अर्थात्, कई रोगाणुओं के लिए प्रवेश द्वार पर, संक्रमण की शुरुआत और विकास को रोकने के लिए अक्सर महत्वपूर्ण होता है।
वैक्सीन का स्थानीय (एरोसोल) प्रशासन, परजीवी से बेहतर, इन्फ्लूएंजा वायरस और बीमारी के साथ संक्रमण से बचाता है। श्वसन पथ में सीधे वैक्सीन की शुरूआत स्रावी एंटीबॉडी के एक उच्च अनुमापांक और चमड़े के नीचे टीकाकरण की तुलना में उनके उत्पादन की लंबी अवधि प्रदान करती है। सीरम एंटीबॉडी के गठन के लिए पैरेन्टल टीकाकरण अधिक प्रभावी है।
बटलर, वाल्डमैन (डब्ल्यू। बटलर, टी। वाल्डिनन) एट अल। (1970) रिपोर्ट है कि स्रावी एंटीबॉडी 24-48 घंटों के बाद दिखाई देते हैं। कॉक्ससेकी वायरस या राइनोवायरस के संक्रमण के बाद, एल्ब्यूमिन और आईजीजी के प्लाज्मा से संक्रमण बाद में देखा गया - बीमारी के दौरान, जिसने IgA (11S) एंटीबॉडी के स्थानीय गठन की पुष्टि की। वे कोशिकाओं से पूर्वनिर्मित एंटीबॉडी की रिहाई से IgA रहस्यों में अपनी प्रारंभिक उपस्थिति की व्याख्या करते हैं, यह सुझाव देते हैं कि विषय पहले टाइप 21 कॉक्ससेकी वायरस और टाइप 15 राइनोवायरस से संक्रमित थे। हालांकि, प्रयोगात्मक अध्ययनों से पता चला है कि इन्फ्लूएंजा वायरस के लिए विशिष्ट एंटीबॉडी 24-48 घंटों के बाद डे नोवो का उत्पादन करना शुरू करते हैं। इसलिए, राज़ों में एंटीबॉडी के शुरुआती स्वरूप की व्याख्या करना असंभव है, साथ ही प्राथमिक प्रतिरक्षित जानवरों के सीरम में उन्हें विकृत कोशिकाओं से मुक्त करके। बल्कि, उनके पहले के गठन की संभावना को मान्यता दी जानी चाहिए, जो कि विभिन्न प्रतिजनों के एंटीबॉडी के संबंध में दिखाया गया है। इन्फ्लूएंजा वैक्सीन का इंट्रामस्क्युलर और उपचर्म प्रशासन नाक के स्राव में एंटीबॉडी को प्रेरित करने के लिए पर्याप्त प्रभावी नहीं है, भले ही सीरम एंटीबॉडी टिटर अपेक्षाकृत अधिक था।
सीरम और नाक स्राव में एंटीबॉडी की सामग्री के बीच कोई संबंध नहीं है। यह सीरम में एंटीबॉडी की उपस्थिति में इन्फ्लूएंजा के कभी-कभी देखे गए मामलों की व्याख्या कर सकता है।
वायरल और बैक्टीरियल मूल के आंतों के संक्रमण के लिए स्रावी एंटीबॉडी कम महत्वपूर्ण नहीं हैं। स्थानीय एंटीजेनिक उत्तेजना से उत्पन्न कोप्रोटेंटिबॉडीज की परिकल्पना की पुष्टि की गई है: एग्लूटीनिन 1 सप्ताह के लिए पेचिश के रोगियों के मल में पाए गए थे। सीरम में संक्रमण जब वे अभी भी अनुपस्थित थे। मौखिक टीकाकरण के बाद, मौखिक टीकाकरण के बाद जानवरों और मनुष्यों में हैजा के वाइब्रोज के एंटीबॉडी पाए गए। पोलियो के रोगियों के मल में वायरस बेअसर करने वाले एंटीबॉडी पाए जाते हैं और टीका लगाया जाता है। स्राव में IgA को IgM को बेअसर करने की एकाग्रता का अनुपात ग्रहणी संबंधी अल्सर पोलियो वायरस के स्रावी एंटीबॉडी के एक स्थानीय उत्पादन का संकेत, सीरम से अधिक था। केलर, ड्वायर (R. Keller, J. Dwyer, 1968) पोलियोमाइलाइटिस IgA एंटीबॉडी वाले रोगियों के मल में पाए गए, जो पोलियोविरस को बेअसर करते हैं, जबकि वे सीरम में अनुपस्थित थे। IgA के अलावा, IgG और IgM मल में होते हैं, जो या तो स्थानीय मूल के हो सकते हैं या रक्त प्लाज्मा से आ सकते हैं।
कम टिटर में IgA एंटीबॉडी आंत में पहले सप्ताह में दिखाई दे सकते हैं। टीका के मौखिक प्रशासन के बाद। एक निष्क्रिय टीका के साथ पैरेंटेरल टीकाकरण, हास्य एंटीबॉडी के गठन को उत्तेजित करता है और इस तरह पोलियोमाइलाइटिस के लकवाग्रस्त रूपों की घटना को रोकता है, हालांकि, संक्रमण के लिए छोटी आंत का प्रतिरोध कुछ हद तक प्रकट होता है। एटीन्यूलेटेड पोलियोवायरस के साथ मौखिक टीकाकरण छोटी आंत के प्रतिरोध की ओर जाता है। सीरम में घूमने वाले एंटीबॉडी विरेमिया को रोक सकते हैं, लेकिन वे श्वसन पथ और आंतों के श्लेष्म झिल्ली की कोशिकाओं के संक्रमण को रोकने में सक्षम नहीं हैं। श्लेष्म झिल्ली की सतहों को धोने वाले केवल एंटीबॉडी वायरस और बैक्टीरिया द्वारा संक्रमण को रोक सकते हैं। स्रावी IgA श्लेष्म झिल्ली की कोशिकाओं में बैक्टीरिया और वायरल वनस्पतियों के नियमन में एक बड़ी भूमिका निभाते हैं, ताकि उन्हें संक्रमण से बचाया जा सके।
आंतों की सामग्री में एंटीबॉडी की उपस्थिति मल से पोलियोवायरस के अलगाव को बाधित कर सकती है, और केवल एक (पीएच 2.2 पर) के साथ परीक्षण सामग्री के उपचार से एंटीजन-एंटीबॉडी जटिल का विघटन होता है और वायरस का पता लगाने के प्रतिशत में वृद्धि होती है। यह तथ्य विवो में कोप्रोटेंटिबॉडी की कार्रवाई को इंगित करता है।
जैसा कि न्यूकॉम्ब, इशिजाका (आर। न्यूकॉम्ब, के। इशिजाका) एट अल के अध्ययन से पता चला है। (1969), डिप्थीरिया टॉक्सोइड के स्थानीय और आंत्रेतर प्रशासन के बाद एंटीबॉडी उत्पादन समान नहीं है। सीरम में अपने स्थानीय मूल की तुलना में सीरम की तुलना में रहस्य (टॉक्सोइड के इंट्रानैसल प्रशासन के साथ) में एंटी-डिप्थीरिया आईजीए एंटीबॉडी (11S) का एक उच्च टिटर। IgA वर्ग (11S) के एंटीबॉडी के साथ, IgG वर्ग के डिप्थीरिया एंटीटॉक्सिन, जो स्थानीय रूप से उत्पन्न हो सकते हैं और रक्त से आ सकते हैं, कुछ व्यक्तियों के नाक स्राव में भी पाए गए थे।
I. के लिए IgD और IgE वर्ग के एंटीबॉडी के महत्व का प्रश्न अभी भी अच्छी तरह से समझा नहीं जा सका है, हालाँकि यह मानने का कारण है कि इन इम्युनोग्लोबुलिन का एक सुरक्षात्मक कार्य भी होता है। हालांकि, आईजीजी, आईजीए और आईजीएम की तुलना में इन एंटीबॉडी की संरचनात्मक विशेषताएं और कार्य और उनकी कम सांद्रता उन्हें शरीर को संक्रमण से बचाने में कम भूमिका निभाने की अनुमति देती है।
टॉन्सिल, एडेनोइड्स, ब्रोन्कियल और मेसेन्टेरिक लिम्फ नोड्स में कोशिकाएं होती हैं जो IgE का उत्पादन करती हैं। तिल्ली में और चमड़े के नीचे लिम्फ नोड्स में, इन कोशिकाओं का खराब प्रतिनिधित्व किया जाता है। पीले ग्रंथि की सामग्री में आईजीडी श्रेणी के एंटीबॉडी पाए जाते हैं। स्थानीय प्लाज्मा कोशिकाओं से उनके स्राव के परिणामस्वरूप, जाहिरा तौर पर एक रास्ता। सेक्रेटरी और सीरम आईजीडी और आईजीई एक ही हैं, उनके पास कोई स्रावी घटक नहीं है।
प्रतिरक्षा सिद्धांत
शरीर को एक बार संक्रामक रोग के लिए प्रतिरक्षा प्राप्त करने की संभावना लंबे समय से ज्ञात है। हालाँकि, इसके कारण लंबे समय तक अज्ञात रहे। चेचक, एंथ्रेक्स, और रेबीज के खिलाफ टीकाकरण ई। जेनर और एल। पाश्चर द्वारा प्रस्तावित टीकों द्वारा पहले ही किए जा चुके हैं, हालांकि, टीकाकरण के परिणामस्वरूप प्राप्त किए गए I. में अंतर्निहित कारकों और तंत्रों में से कोई भी स्थापित नहीं किया गया है।
इस समस्या को हल करने के लिए बहुत महत्वपूर्ण रोगाणुओं की खोज थी - बीमारी का एक विशिष्ट कारण। इसलिए यह कोई संयोग नहीं है कि प्रतिरक्षा विज्ञान के विकास में पहली सफलता सीधे माइक्रोबायोलॉजी द्वारा प्राप्त की गई सफलताओं की है। रोगजनकों की खोज, उनके विषाक्त पदार्थों ने उन कारकों और तंत्रों के अध्ययन के करीब आना संभव बना दिया जो उनका मुकाबला करते हैं।
"पर्यावरण की कमी" का सिद्धांत1880 में एल। पाश्चर द्वारा प्रस्तावित, अधिग्रहित I. के कारण की व्याख्या करने वाले पहले प्रयासों में से एक था। प्रतिरक्षा, जो एक बार एक बीमारी का सामना करने के परिणामस्वरूप हुई, इस तथ्य से समझाया गया कि रोगाणुओं ने अपने जीवन के लिए आवश्यक पदार्थों का पूरी तरह से उपयोग किया, जो शरीर में बीमारी से पहले थे, और इसलिए, उन्होंने इसे फिर से पुन: पेश नहीं किया, जैसे वे लंबे समय तक खेती में कृत्रिम पोषक माध्यम पर प्रजनन करने के लिए संघर्ष करते हैं।
उसी समय पर लागू होता है प्रतिरक्षा का प्रतिधारण सिद्धांतचौवेउ (आई। बी। ए। चौवेउ) द्वारा प्रस्तावित, एक कटौती के अनुसार, विशेष चयापचय उत्पादों के शरीर में संचय द्वारा जीवाणुओं की वृद्धि मंदता को समझाया गया था जो रोगाणुओं के आगे विकास को रोकते हैं। हालांकि पी। के प्रतिधारण सिद्धांत, साथ ही "पर्यावरण की कमी," की परिकल्पना अटकलबाजी थी, फिर भी वे कुछ हद तक उद्देश्य वास्तविकता को प्रतिबिंबित करते थे। शवो की परिकल्पना में पहले से ही संक्रमण की संभावना के परिणामस्वरूप संक्रमण था या कुछ नए पदार्थों के प्रतिरक्षण के परिणामस्वरूप जो माध्यमिक संक्रमण के मामले में रोगाणुओं की गतिविधि को रोकते हैं। जैसा कि बाद में दिखाया गया है, एंटीबॉडीज हैं।
फागोसाइटिक इम्युनिटी सिद्धांतकट का संस्थापक आई। आई। मेचनिकोव था, जो प्रतिरक्षा का पहला प्रायोगिक सिद्धांत था। एल। पाश्चर ने एक नई और मूल दिशा के रूप में उनकी प्रशंसा की। 1883 में ओडेसा में पहली बार व्यक्त किया गया था, बाद में इसे I. I. Mechnikov और उनके कई सहयोगियों और छात्रों द्वारा पेरिस में सफलतापूर्वक विकसित किया गया था। फागोसिटिक सिद्धांत, ऊपर वर्णित झुंड का सार, बार-बार गर्म वैज्ञानिक चर्चाओं का विषय रहा है, और कई वर्षों तक इसके लेखक को कई विश्व प्रसिद्ध वैज्ञानिकों - पी। बॉमटार्टन, आर। कोच, आर। फाफिफ़र के साथ वैज्ञानिक विवादों में अपने विचार की शुद्धता का बचाव करना पड़ा। K. Flugge et al। समय और तथ्य, हालांकि, संक्रमण से शरीर की रक्षा करने में फागोसाइटिक प्रतिक्रिया के सर्वोपरि महत्व की पुष्टि करते हैं, और I के फागोसाइटिक सिद्धांत को सामान्य मान्यता मिली। इसके बाद, इसके लिए शोधन और परिवर्धन किए गए। यह पाया गया कि फागोसाइट्स द्वारा रोगजनकों के कब्जे और पाचन शरीर की रक्षा करने वाले एकमात्र कारक से बहुत दूर है। ऐसे रोगाणु हैं, जैसे वायरस, जिसके लिए अपने आप में फागोसाइटोसिस उतना महत्वपूर्ण नहीं है जितना कि जीवाणु संक्रमण, और केवल एंटीबॉडी के वायरस के लिए एक प्रारंभिक जोखिम उनके कब्जा और विनाश में योगदान कर सकता है।
यह असंभव था, केवल फागोसाइटिक सिद्धांत पर आधारित, विषाक्त पदार्थों के लिए प्रतिरोध का तंत्र समझाने के लिए। 1888 में ई। रूओ और ए। यर्सिन द्वारा डिप्थीरिया विष की खोज, और ई। बेरिंग और एस कितासो द्वारा 1890 में एंटी-टेटनस और फिर डिप्थीरिया एंटीटॉक्सिन एक तथ्य था, जो किसी को फागोसिटिक सिद्धांत की सीमा से परे जाने और सुरक्षात्मक के साथ रेकन करने के लिए मजबूर करता था। हास्य तंत्र की कार्रवाई। आई। आई। मेचनिकोव की प्रयोगशाला में, उनके छात्रों और sotr। - जे बॉर्डे, एफ। वाई। चिस्टोविच और अन्य - हास्य I के कारकों के मौलिक अध्ययन किए गए थे - लिटिक एजेंटों की प्रकृति और गुणों का अध्ययन किया गया था, पशु मूल के प्रोटीनों के प्रीप्रिटिटिन की खोज की गई थी।
एंटीबॉडी के महत्व को नकारे बिना, I. I. Mechnikov ने सुझाव दिया कि वे फागोसाइट्स द्वारा निर्मित होते हैं। मैक्रोफेज सीधे प्लाज्मा कोशिकाओं द्वारा इम्युनोग्लोबुलिन के निर्माण में शामिल होते हैं, और स्वयं लिम्फोइड कोशिकाएं, जो मेचनकोव के माइक्रोफेज के मूल में समान हैं, एंटीजन (टी कोशिकाओं) को पहचानने और इम्युनोग्लोबुलिन (बी कोशिकाओं) को संश्लेषित करने के दोनों कार्य करते हैं। फागोसाइटिक प्रतिक्रियाएं एक शक्तिशाली, लेकिन शरीर को कीटाणुओं से बचाने के लिए व्यापक, तंत्र से दूर हैं। उदाहरण के लिए, शरीर को जानवरों और पौधों की उत्पत्ति के विषाक्त पदार्थों और अन्य घुलनशील विदेशी एंटीजन से बचाने के लिए, साथ ही वायरस से, मुख्य भूमिका हास्य कारकों - एंटीटॉक्सिन और अन्य एंटीबॉडी की है। एंटीबॉडीज को श्रद्धांजलि देते हुए, हालांकि, यह ध्यान दिया जाना चाहिए कि उन्हें मिलाकर, उदाहरण के लिए, विष के साथ इसका विनाश नहीं होता है, और इसे कृत्रिम परिस्थितियों में फिर से बहाल किया जा सकता है। एंटीबॉडी द्वारा बेअसर परिसरों को फागोसाइटिक कोशिकाओं द्वारा कब्जा कर लिया जाता है और पच जाता है। एक विदेशी एंटीजेनिक एजेंट के लिए एक सेल प्रतिक्रिया न केवल एक फागोसिटिक प्रतिक्रिया है, बल्कि प्रतिरक्षा कोशिकाओं की प्रतिक्रिया भी है, जो एंटीबॉडी के गठन के लिए अग्रणी है। शरीर की सुरक्षा के एक एकल तंत्र, सेलुलर और विनोदी कारकों में इतनी बारीकी से जुड़ा हुआ है।
I.I. मेचनकोव ने सेलुलर रक्षा प्रतिक्रिया के एक पक्ष पर जोर दिया - फागोसाइटिक। हालांकि, विज्ञान के बाद के विकास ने दिखाया कि फागोसाइटिक कोशिकाओं के कार्य अधिक विविध हैं: फागोसाइटोसिस के अलावा, वे एंटीबॉडी, इंटरफेरॉन, लाइसोजाइम और अन्य पदार्थों के उत्पादन में भाग लेते हैं जो आई के गठन में बहुत महत्व रखते हैं। इसके अलावा, यह स्थापित किया गया है कि नहीं केवल लिम्फोइड ऊतक कोशिकाएं, बल्कि अन्य भी। इंटरफेरॉन, उदाहरण के लिए, सभी कोशिकाओं का उत्पादन करने में सक्षम है, स्रावी एंटीबॉडी के ग्लाइकोप्रोटीन टुकड़े श्लेष्म झिल्ली के उपकला कोशिकाओं, कई कोशिकाओं द्वारा निर्मित होते हैं, और न केवल रेटिकुलोओथियलियल सिस्टम की कोशिकाएं, वायरल इनहिबिटर का उत्पादन करती हैं। ये तथ्य, साथ ही साथ कई अन्य लोग एक व्यापक अर्थ में सेलुलर प्रतिरक्षा के बारे में बात करने का कारण देते हैं, जिसमें फ़ैगोसाइटिक प्रतिक्रिया सबसे महत्वपूर्ण और विकासवादी रूप से रक्षा का सबसे पुराना रूप है। इसके साथ ही आई के फागोसिटिक सिद्धांत के साथ, एक हास्य प्रवृत्ति विकसित हुई, संक्रमण से बचाने में एक प्रमुख भूमिका शरीर के तरल पदार्थ और रस (रक्त, लसीका, रहस्य) को सौंपी गई, जिसमें ऐसे पदार्थ होते हैं जो रोगाणुओं और उनके चयापचय उत्पादों को बेअसर करते हैं।
प्रतिरक्षा का हास्य सिद्धांत कई प्रमुख शोधकर्ताओं द्वारा बनाया गया, इसलिए इसे केवल पी। एर्लिच के नाम से जोड़ना अनुचित है, हालांकि वह निस्संदेह एंटीबॉडी से संबंधित कई मौलिक खोजों का मालिक है।
जे। फोडोर (1887), और फिर जे। न्यूटॉल (1888) ने रक्त सीरम के जीवाणुनाशक गुणों की सूचना दी। जी। बुचनर (1889) ने स्थापित किया कि यह संपत्ति सीरम में विशेष थर्मोलैबाइल "सुरक्षात्मक पदार्थों" की उपस्थिति पर निर्भर करती है, जिसे उन्होंने एलेक्सिंस कहा था। जे। बोर्डे (1898), जिन्होंने आई। आई। मेचनिकोव की प्रयोगशाला में काम किया, ने विभिन्न गुणों के साथ दो सीरम सब्सट्रेट के साइटोकाइडल प्रभाव में भागीदारी का प्रमाण प्रस्तुत किया - थर्मोलैबील पूरक और थर्मोस्टेबल एंटीबॉडी। विनोदी I के सिद्धांत के गठन के लिए महान महत्व ई। बेरिंग और की खोज थी
एस कितासातो (1890) टेटनस और डिप्थीरिया विषाक्त पदार्थों को बेअसर करने के लिए प्रतिरक्षा सीरा की क्षमता, और पी। एर्लिच (1891) - एंटीबॉडी जो पौधे के विष को बेअसर करते हैं (रिकिन, एबरीन)। हैजा विब्रियो-प्रतिरोधी गिनी सूअरों से प्राप्त प्रतिरक्षा सीरा में, आर। फाफिफ़र (1894) में एंटीबॉडी पाए गए जो रोगाणुओं को भंग करते हैं; इन सीरा को गैर-प्रतिरक्षा जानवरों के लिए पेश करने से उन्हें हैजा विब्रियो का प्रतिरोध हुआ (देखें इसेव-प्यूफीफर घटना)। रोगाणुओं की खोज करने वाले रोगाणुओं की खोज [ग्रबेर, डरहम (एम। ग्रुबर, एच। डरहम), 1896], साथ ही एंटीबॉडी उनके महत्वपूर्ण कार्यों [क्रस (आर। क्रैस), 1897] के उत्पादों को उपजी हैं, रोगाणुओं और उत्पादों पर हास्य कारकों के प्रत्यक्ष प्रभाव की पुष्टि की। उनकी आजीविका। डिप्थीरिया के विषाक्त रूप के इलाज के लिए ई। आरयू (1894) सीरम की प्राप्ति ने शरीर को संक्रमण से बचाने में हास्य कारकों की भूमिका के विचार को मजबूत किया।
सेलुलर और विनोदी I के समर्थकों के लिए यह प्रतीत होता है कि ये दिशाएं तेज, अपरिवर्तनीय विरोधाभास थीं। हालांकि, विज्ञान के आगे के विकास से पता चला कि आई के सेलुलर और विनोदी कारकों के बीच एक करीबी बातचीत है। उदाहरण के लिए, ओपोनिसिन, एग्लूटीनिन और अन्य एंटीबॉडी जैसे विनोदी पदार्थ फैगोसाइटोसिस में योगदान करते हैं: रोगजनक रोगाणुओं में शामिल होने से, वे फागोसिटिक कोशिकाओं द्वारा कब्जा और पाचन के लिए उन्हें अधिक सुलभ बनाते हैं। बदले में, फागोसाइटिक कोशिकाएं एंटीबॉडी उत्पादन में अग्रणी सहकारी सेलुलर इंटरैक्शन में भाग लेती हैं।
आधुनिक पदों से यह स्पष्ट है कि मैं के सेलुलर और विनोदी सिद्धांत दोनों ने अपने व्यक्तिगत पक्षों को सही ढंग से प्रतिबिंबित किया है, अर्थात, वे एकतरफा थे, और इस घटना को पूरी तरह से कवर नहीं किया था। दोनों सिद्धांतों के मूल्य की मान्यता 1908 में आई। आई। मेचनिकोव और नोबेल पुरस्कार के पी। एर्लिच को प्रतिरक्षा विज्ञान के विकास में उत्कृष्ट सेवाओं के लिए एक साथ दिया गया था। पी। एर्लिच (1897) उन पहले लोगों में से एक थे जिन्होंने कोशिकाओं द्वारा एंटीबॉडी गठन के तंत्र में घुसने की कोशिश की। अंतिम, जैसा कि उन्होंने माना, एक ही कोशिकाओं द्वारा निर्मित होते हैं, और एंटीजन, नैप्र, एक विष क्रिम के साथ बातचीत करता है। पी। एर्लिच की यह स्थिति, हालांकि, पुष्टि नहीं थी। टेटनस टॉक्सिन में तंत्रिका ऊतक की कोशिकाओं के लिए एक ट्रॉपिज्म होता है, और एंटीटॉक्सिन, अन्य सभी एंटीबॉडी की तरह, केवल प्लाज्मा कोशिकाओं द्वारा निर्मित होता है, जिसकी परवाह किए बिना सेलुलर सिस्टम प्रतिजन के लिए हानिकारक है।
पी। एर्लिच की सबसे महत्वपूर्ण उपलब्धियों में से एक है रिसेप्टर सिद्धांत। एंटीटॉक्सिन और विष-संवेदनशील कोशिकाओं, साथ ही कोशिकाओं और एंटीबॉडी के साथ किसी भी एंटीजन के साथ विषाक्त पदार्थों की बातचीत का आधार रासायनिक रखा गया था। सिद्धांत प्रत्येक प्रतिजन और एंटीबॉडी के लिए विशिष्ट रिसेप्टर-विशिष्ट संरचनाओं की उपस्थिति है, जिसके माध्यम से कोशिकाओं, एंटीजन और एंटीबॉडी के बीच बातचीत होती है। पदार्थों को ठीक करने वाले रिसेप्टर्स की अवधारणाएं - केमोरिसेप्टर्स, साथ ही एंटीजन को ठीक करने वाले रिसेप्टर्स पेश किए गए थे। पी। एर्लिच, एंटीबॉडीज के अनुसार, कोशिकाओं से अलग किए गए रिसेप्टर्स हैं। रिसेप्टर सिद्धांत का निर्माण करने के बाद, पी। एर्लिच ने कई तरह से एंटीबॉडी गठन के आधुनिक सिद्धांतों, एंटीजन के साथ उनकी बातचीत का अनुमान लगाया। टी-कोशिकाओं में विशिष्ट इम्युनोग्लोबुलिन रिसेप्टर्स की उपस्थिति जो बी-कोशिकाओं और मैक्रोफेज में एंटीजन, रिसेप्टर्स को पहचानती है, एंटीबॉडी अणुओं में सक्रिय केंद्र और एंटीजन में पूरक निर्धारक समूह आधुनिक इम्यूनोलॉजी की सबसे महत्वपूर्ण उपलब्धियों में से एक है। I.I. मेचनकोव और पी। एर्लिच के कार्यों के आधार पर, I के अध्ययन में सेलुलर और विनोदी निर्देश सफलतापूर्वक विकसित होते रहते हैं।
आई। आई। मेचनिकोव और पी। एर्लिच के समय से, आई के कई सिद्धांत प्रस्तावित किए गए हैं, हालांकि शब्द के सख्त अर्थ में वे विशेष सिद्धांतों के नाम का दावा नहीं कर सकते थे, क्योंकि वे केवल अलग, महत्वपूर्ण, लेकिन विशेष मुद्दों से निपटते हैं: एंटीबॉडी गठन का तंत्र, उनका विशिष्टता, एंटीबॉडी के साथ एंटीजन के संयोजन का तंत्र, सामान्य रूप से I. की घटना की व्याख्या नहीं की, अर्थात्, वंशानुगत और शरीर की प्रतिरक्षा को विभिन्न संक्रामक रोगों के तंत्र। इनमें से कई सिद्धांत केवल ऐतिहासिक रुचि के हैं।
सामान्य प्रतिरक्षा विज्ञान के विकास में एक महत्वपूर्ण योगदान एफ। बर्नेट (1972) के प्रयोगात्मक और सैद्धांतिक अध्ययन द्वारा किया गया था, एंटीबॉडी गठन के क्लोनल चयन सिद्धांत के लेखक (एंटीबॉडी देखें)। इस सिद्धांत ने प्रतिरक्षाविज्ञानी कोशिकाओं के अध्ययन में योगदान दिया, एंटीजन, एंटीबॉडी उत्पादन और इम्यूनोल के उद्भव की विशिष्ट मान्यता में उनकी भूमिका। सहिष्णुता, स्व-प्रतिरक्षी प्रक्रियाएं, एलर्जी।
I. के विशिष्ट और गैर-विशिष्ट कारकों और तंत्र के अध्ययन में कुछ प्रगति के बावजूद, इसके कई पहलुओं का खुलासा होने से बहुत दूर है। यह ज्ञात नहीं है कि, कुछ संक्रमणों (खसरा, चेचक, गलसुआ, पोलियोमाइलाइटिस, टुलारेमिया, आदि) के संबंध में, शरीर एक तनाव और लंबे समय तक चलने में सक्षम है, और अन्य संक्रमणों के संबंध में, मैं शरीर द्वारा अर्जित अल्पकालिक है, और एक ही प्रकार प्रतिजन है। माइक्रोब अपेक्षाकृत कम अंतराल पर फिर से बीमारी का कारण बन सकता है। बैक्टीरियल कैरिज के साथ प्रतिरक्षा कारकों की कम प्रभावशीलता के कारणों, साथ ही साथ ह्रोन और अव्यक्त संक्रमण के प्रेरक एजेंट, उदाहरण के लिए, दाद सिंप्लेक्स वायरस, जो लंबे समय तक और कभी-कभी जीवन के लिए शरीर में बने रह सकते हैं और संक्रमण के समय-समय पर होने वाले संक्रमण का कारण नहीं बन सकते हैं। अन्य रोग बाँझपन में कैसे समाप्त होते हैं। यह केवल हर्पीस वायरस की क्षमता से प्रभावित सेल से सामान्य से सीधे गुजरने के लिए, बाह्य कोशिकीय को दरकिनार करके समझाने के लिए संभव है। चूंकि सेल से सेल में संक्रमण का एक ही तंत्र चेचक वायरस में भी मनाया जाता है, जो लगातार बाँझ होने का कारण बनता है। यह स्थापित नहीं किया गया है कि क्यों कुछ मामलों में मैं के कारक और तंत्र संक्रामक प्रक्रिया को खत्म करने और पैथोलॉजिकल एजेंटों के शरीर को मुक्त करने में सक्षम हैं, और कई वर्षों से अन्य मामलों में। सूक्ष्मजीव और शरीर के बीच एक प्रकार का संतुलन स्थापित किया जाता है, समय-समय पर एक दिशा या दूसरी (तपेदिक, कुष्ठ रोग, आदि) में परेशान होता है।
जाहिर है, प्रतिरक्षा के सभी संक्रमणों और जीवों के रोगाणुओं से मुक्त होने के लिए कोई एकल तंत्र सार्वभौमिक नहीं है। विभिन्न संक्रमणों के रोगजनन की विशेषताएं I प्रदान करने वाले तंत्रों की विशेषताओं में परिलक्षित होती हैं, हालांकि, सामान्य सिद्धांत हैं जो रोगाणुओं और अन्य विदेशी एंटीजेनिक पदार्थों से सुरक्षा की विधि की विशेषता रखते हैं। यह प्रतिरक्षा के एक सामान्य सिद्धांत के निर्माण का आधार प्रदान करता है। I.-कोशिकीय और विनोदी के दो पहलुओं का आवंटन - पद्धतिगत और शैक्षणिक विचारों द्वारा उचित है। हालांकि, इन तरीकों में से कोई भी सिद्धांत के सिद्धांत को बनाने के लिए पर्याप्त आधार प्रदान नहीं करता है जो पूरी तरह से मनाया घटना के सार को प्रतिबिंबित करेगा। कृत्रिम रूप से अलग-थलग दोनों सेलुलर और हास्य कारक, घटना के केवल कुछ पहलुओं की विशेषता रखते हैं, लेकिन पूरी प्रक्रिया नहीं। आधुनिक सिद्धांत के निर्माण में, मुझे एक स्थान और सामान्य भौतिक विज्ञान भी खोजना होगा। कारक और तंत्र: बुखार, स्रावी-मलमूत्र और एंजाइम संबंधी कार्य, न्यूरोहोर्मोनल प्रभाव, चयापचय गतिविधि, आदि आणविक, सेलुलर और सामान्य फिजियोल। रोगाणुओं और अन्य विदेशी एंटीजेनिक पदार्थों से शरीर की रक्षा करने वाली प्रतिक्रियाओं को एक एकल, परस्पर, विकसित रूप से और आनुवंशिक रूप से निर्धारित प्रणाली के रूप में प्रस्तुत किया जाना चाहिए। इसलिए, यह स्वाभाविक है कि विदेशी प्रतिजन के लिए प्रतिरक्षा प्रतिक्रिया के आनुवंशिक निर्धारण के साथ-साथ नव अधिग्रहीत कारकों और तंत्रों को भी ध्यान में रखा जाना चाहिए जब मैं आधुनिक सिद्धांत का निर्माण करता हूं।
प्रतिरक्षा प्रतिक्रियाएं न केवल रोगाणुओं और उनके चयापचय उत्पादों के खिलाफ सुरक्षा का एक विशेष कार्य करती हैं, बल्कि उनके पास एक और, अधिक विविध फिजियोलॉजी, फ़ंक्शन भी हैं। प्रतिरक्षा प्रतिक्रियाएं शरीर के विभिन्न अंगों से इसे छोड़ने में भी हिस्सा लेती हैं और क्षतिग्रस्त त्वचा (आर्थ्रोपोड जहर, सांप) के साथ-साथ चिकित्सा उद्देश्यों (सीरम, रक्त, ड्रग्स, एलोजेनिक ट्रांसप्लांट) के लिए कृत्रिम रूप से पेश किए गए एंटीजेनिक पदार्थों का परीक्षण करती हैं। । शरीर इन सभी सब्सट्रेट्स का जवाब देता है, आनुवंशिक रूप से प्राप्तकर्ता एंटीजन से अलग, विशिष्ट और गैर-विशिष्ट सेलुलर, हास्य और सामान्य फिजियोल के एक जटिल द्वारा। प्रतिक्रियाएँ जो उनके विनाश, अस्वीकृति और उन्मूलन में योगदान करती हैं। प्रायोगिक जानवरों में घटना की रोकथाम में प्रतिरक्षा प्रतिक्रियाओं का महत्व साबित हुआ है। घातक ट्यूमर वायरल एटियोलॉजी (देखें। इम्युनिटी एंटीटूमर)।
इसकी परिकल्पना की गई है (एफ। वर्नेट, 1962; आर.वी. पेट्रोव, 1976) कि शरीर की प्रतिरक्षा प्रणाली दैहिक कोशिकाओं की आबादी की आनुवंशिक स्थिरता की देखरेख का कार्य करती है। विशिष्ट और गैर-विशिष्ट रक्षा प्रतिक्रियाएं पृथ्वी पर जीवन के संरक्षण में महत्वपूर्ण भूमिका निभाती हैं। हालांकि, अन्य लोगों की तरह, प्रतिरक्षा प्रतिक्रियाओं की पूर्णता सापेक्ष है, और कुछ शर्तों के तहत वे नुकसान ला सकते हैं। उदाहरण के लिए, एक जीव एक हिंसक और तेजी से प्रतिक्रिया के साथ एक विदेशी प्रोटीन की बड़ी खुराक के बार-बार सेवन का जवाब देता है, किनारा घातक हो सकता है (देखें। एनाफिलेक्टिक झटका)। सूजन के रूप में इस तरह के एक शक्तिशाली रक्षात्मक प्रतिक्रिया की विशेषता भी हो सकती है, जो, यदि एक महत्वपूर्ण अंग में स्थानीयकृत होती है, तो कभी-कभी ऊतकों को बड़ी और अपूरणीय क्षति होती है।
व्यक्तिगत सुरक्षात्मक कारकों का कार्य न केवल कमजोर हो सकता है, बल्कि बदल भी सकता है। यदि विदेशी एजेंटों - बैक्टीरिया, विषाक्त पदार्थों, वायरस आदि के विनाश के लिए सामान्य प्रतिरक्षा प्रतिक्रियाओं का उद्देश्य होता है, तो पैथोलॉजी में ये प्रतिक्रियाएं अपने स्वयं के सामान्य, अपरिवर्तित कोशिकाओं और ऊतकों के खिलाफ कार्य करना शुरू कर देती हैं।
I. के घोषणापत्र विविध हैं, जिनमें से मुख्य हैं: दोहराया आक्रमण की तीव्रता और तीव्रता में कमी, हेलमन्थ्स के विकास में मंदी और उनके जीवन की अवधि में कमी, प्रजनन गतिविधि का निषेध। मैं माँ से दूध के साथ और नाल के माध्यम से संतानों में फैलता है।
त्वचीय और श्लैष्मिक लीसेमैनियासिस मुख्य रूप से अनुपस्थिति या बहुत कम एंटीबॉडी टाइटर्स में विलंबित प्रकार की अतिसंवेदनशीलता प्रतिक्रियाओं (एचआरटी) के विकास की विशेषता है। और संक्रमण के इन रूपों के साथ निरपेक्ष है और या तो धीरे-धीरे विकसित हो सकता है, प्राथमिक प्रक्रिया (लीशमैनिया ट्रोपिका माइनर) के पूरा होने की अवधि तक पूरा हो रहा है, या अधिक तेज़ी से जब अतिरंजना के लिए प्रतिरक्षा पहले से ही अल्सर (ज़ूनोटिक त्वचा लीशमैनियासिस) के चरण में होती है। ह्रोन के साथ त्वचीय लीशमैनियासिस के रूप हैं, बेशक, कीमोथेरेपी के लिए उत्तरदायी नहीं है, जिसमें मैं दबा हुआ हूं।
रक्त में आंत के लीशमैनियासिस के साथ, आईजीएम और आईजीजी की एक उच्च एकाग्रता देखी जाती है, जबकि एचआरटी प्रतिक्रियाएं अलग-अलग रूप से व्यक्त की जाती हैं और इलाज के बाद अलग-अलग समय पर विकसित होती हैं। संक्रमण के शुरुआती चरणों में पहले से ही एंटीबॉडी का पता लगाया जाता है और पूरे सक्रिय चरण में उच्च अनुमापांक में पता लगाया जाता है (सफल उपचार के बाद वे कुछ महीनों के बाद गायब हो जाते हैं)। एंटीबॉडी का सुरक्षात्मक प्रभाव स्पष्ट नहीं है, क्योंकि रक्त में उच्च टाइटर्स में उनकी उपस्थिति रोगी को मृत्यु से नहीं बचाती है। हाल के वर्षों में, आंत के लीशमैनियासिस और एचआरटी के विकास से उबरने के बाद हासिल की गई प्रतिरक्षा के बीच एक संबंध दिखाया गया है।
झील के टी।, विभिन्न प्रोटोजोअल संक्रमणों में आई की अभिव्यक्तियाँ और तंत्र समान नहीं हैं। उल्लेखनीय संक्रामक संक्रमणों और आक्रमणों के संबंध में प्रोटोजोआ (प्लास्मोडिया, टॉक्सोप्लाज्मा, लीशमैनिया) के एक नंबर के लिए मनाया जाने वाला चिह्नित इम्युनोसप्रेसिव प्रभाव है, जिसकी प्रकृति अभी तक स्थापित नहीं हुई है।
बच्चों में प्रतिरक्षा की विशेषताएं
इम्युनोल, एक बच्चे के शरीर की प्रतिक्रियाशीलता का ओटोजेनेसिस में विकास का अपना पैटर्न है। एक नवजात शिशु के लिए बहुत महत्व है, मैं मां के आईजीजी द्वारा प्रतिनिधित्व करता हूं। इसमें विभिन्न प्रकार के एंटीटॉक्सिन, एंटीवायरल और जीवाणुरोधी एंटीबॉडी शामिल हैं। हालांकि, नवजात शिशु में ग्राम-नकारात्मक सूक्ष्मजीवों के एंटीबॉडी की कमी होती है जो नाल में प्रवेश नहीं करते हैं। यह प्रासंगिक संक्रमणों के विकास के लिए अनुकूल परिस्थितियों का निर्माण करता है। कॉर्ड सीरम आईजीजी स्तर मातृ स्तरों के साथ सहसंबद्ध होते हैं, लेकिन अक्सर सक्रिय ट्रांसप्लासेंट ट्रांसपोर्ट द्वारा आईजीजी को केंद्रित करने की भ्रूण की क्षमता के कारण अधिक होते हैं। यह प्रक्रिया गर्भावस्था के अंतिम हफ्तों में सबसे अधिक तीव्रता से आगे बढ़ती है, इसलिए, समय से पहले शिशुओं में आईजीजी की सामग्री कम होती है, जो कि पूर्व जन्म के समय की अवधि होती है। जन्म के तुरंत बाद, निष्क्रिय रूप से प्राप्त आईजीजी का अपचय शुरू होता है, कटौती की सामग्री अधिकतम 6-9 महीने तक कम हो जाती है। जीवन का।
भ्रूण के जीवन के शुरुआती समय में बच्चे की अपनी प्रतिरक्षा प्रणाली की परिपक्वता शुरू होती है। भ्रूण लिम्फोसाइट्स 12 वें सप्ताह से थाइमस में तीव्रता से गुणा करते हैं। गर्भावस्था में, वे फाइटोएम्ग्लगुटिनिन का जवाब देते हैं, अर्थात, कार्यात्मक रूप से सक्रिय हैं। उनमें सतह से बंधे लिम्फोसाइट्स आईजीएम और आईजीजी होते हैं। थाइमस न केवल लिम्फोसाइटों का एक स्रोत है, बल्कि आनुवंशिक रूप से निर्धारित इम्युनोल को भी नियंत्रित करता है। परिपक्वता। इम्युनोल, लिम्फोइड कोशिकाओं के कुछ क्लोनों की दक्षता अलग-अलग समय पर पहुंचती है। सबसे पहले वायरस एंटीजन, साल्मोनेला फ्लैगेलर एंटीजन, स्टेफिलोकोकस एंटीजन, कुछ खाद्य एंटीजन के प्रति प्रतिरक्षा प्रतिक्रिया की क्षमता है। व्यापक बैक्टीरिया और वायरस के एंटीजन द्वारा लिम्फोइड कोशिकाओं के प्लेसेंटा और अंतर्गर्भाशयी तैयारी के माध्यम से एंटीजन की एक निश्चित मात्रा में प्रवेश की अनुमति है। प्रतिरक्षा प्रतिक्रिया की उपस्थिति के समय में अंतर कोशिकाओं की एंजाइमैटिक स्थिति की अपरिपक्वता के साथ भी जुड़ा हो सकता है जो एंटीजन के प्राथमिक प्रसंस्करण को पूरा करते हैं।
प्रतिरक्षा प्रणाली का कार्य, अर्थात्, एंटीबॉडी का संश्लेषण और विलंबित प्रकार की एलर्जी का विकास, केवल एंटीजेनिक उत्तेजना के साथ होता है। इसलिए, इसके लिए प्रेरणा नवजात शिशु का सूक्ष्म संदूषण है, जो जन्म के बाद होता है। एक विशेष रूप से महत्वपूर्ण भूमिका बैक्टीरिया द्वारा निभाई जाती है जो ग्रंथियों को आबाद करती है। पथ। नवजात शिशुओं के शरीर को संश्लेषित करने वाला पहला इम्युनोग्लोबुलिन आईजीएम है। इसकी सामग्री जीवन के पहले सप्ताह में और दूसरों की तुलना में पहले (1 वर्ष तक) वयस्कों के स्तर की विशेषता तक पहुंच जाती है। IgA को 2-3 वें सप्ताह से संश्लेषित किया जाता है। यह अधिक धीरे-धीरे बढ़ता है और 7-12 वर्षों तक वयस्कों के स्तर तक पहुंच जाता है। IgG संश्लेषण की शुरुआत व्यक्तिगत है, इसका संश्लेषण 1 महीने में पहले से ही साबित हो चुका है। जीवन, हालांकि, निष्क्रिय रूप से प्राप्त आईजीजी का अपचय इसके संश्लेषण से इतना अधिक हो जाता है कि आईजीजी स्तर में वृद्धि केवल 2-3 महीनों के बाद ही कब्जा होना शुरू हो जाती है। आईजीजी एक वयस्क के समान स्तर पर पहुंचता है, बाद में अन्य इम्युनोग्लोबुलिन की तुलना में। नवजात शिशुओं में, पीले-क्विक का उपनिवेशण। पथ माइक्रोफ्लोरा 4-6 महीने के बच्चों में मल में आईजीए के स्थानीय उत्पादन की ओर जाता है। वयस्कों के पास जाना। 1 महीने में ब्रोन्कियल स्राव में IgA की सामग्री। बच्चे का जीवन, इसके विपरीत, बहुत कम है और जीवन के दूसरे भाग में ही तेजी से बढ़ता है।
प्रतिरक्षा प्रणाली की परिपक्वता बिगड़ा जा सकता है, और इसके कामकाज की शुरुआत पहले इम्यूनोल, मां-भ्रूण के संघर्ष और भ्रूण के अंतर्गर्भाशयी संक्रमण के साथ हुई। संक्रमण के मामले में, इम्युनोग्लोबुलिन का संश्लेषण जन्म से पहले शुरू होता है। IgM संश्लेषण में सबसे स्पष्ट वृद्धि, जिसका स्तर 20 mcg / 100 ml से ऊपर है, को अंतर्गर्भाशयी संक्रमण का अप्रत्यक्ष संकेतक माना जाता है। नवजात शिशु में संक्रामक और भड़काऊ रोगों के विकास के साथ, इम्युनोग्लोबुलिन का एक बढ़ा हुआ संश्लेषण, विशेष रूप से आईजीएम भी होता है। आईजीएम सामान्यीकृत प्रक्रियाओं में तेजी से बढ़ता है, वायरल संक्रमण। जन्म के बाद के विकास के शुरुआती चरणों में एंटीजन का जवाब देने की क्षमता के उद्भव के साथ लिम्फोइड ऊतक का विकास समाप्त नहीं होता है। यह पूरे बचपन की अवधि के दौरान जारी रहता है और केवल यौवन में समाप्त होता है। उम्र के साथ, लिम्फोइड ऊतक का विकास, मेमोरी कोशिकाओं का संचय, और नियामक तंत्र का सुधार जारी है। एंटीबॉडी के गठन की तीव्रता और सेलुलर प्रतिरक्षा की गंभीरता लगातार बढ़ रही है।
एंटी-ऑर्गन एंटीबॉडी और एंटी-गैमाग्लोबुलिन जमा होते हैं। पर्यावरण, संक्रामक और भड़काऊ रोगों की आवृत्ति, और निवारक टीकाकरण I. गठन की प्रक्रिया को प्रभावित करते हैं। प्रतिरक्षा प्रणाली की परिपक्वता और इसके उचित कामकाज पर उत्तरार्द्ध का प्रभाव अभी भी खराब समझा जाता है। टीकाकरण को इम्युनोल, संकेतक के नियंत्रण में व्यक्तिगत किया जाना चाहिए।
वंशानुगत (प्रजाति) I के कारकों के विकास के अपने नियम भी हैं। उचित उत्तेजनाओं की कमी के कारण उनका अंतर्गर्भाशयी संश्लेषण भी सीमित है। एक अपवाद लाइसोजाइम है, जिसकी गतिविधि कॉर्ड सीरम में बहुत अधिक है। लाइसोजाइम की एक बहुत बड़ी मात्रा एम्नियोटिक द्रव में निहित है। एक बच्चे का जन्म वंशानुगत I. के कारकों के विकास के लिए एक शक्तिशाली प्रोत्साहन है, जिसकी गतिविधि जीवन के पहले दिनों में तेजी से बढ़ जाती है। उनके उत्पादन के लिए उत्तेजना नवजात शिशुओं के रहने की स्थिति में परिवर्तन और शरीर के सामान्य अनुकूली प्रतिक्रिया के विकास के साथ जुड़े कारकों का पूरा परिसर है। समय पर जन्म लेने वाले बच्चों की तुलना में जन्म के पहले और उसके बाद के हफ्तों में दोनों के समय में गैर-सुरक्षात्मक सुरक्षात्मक संकेतक कम होते हैं। गैर-विशिष्ट सुरक्षात्मक कारकों की आगे की गतिशीलता समान नहीं है। पूरक की सामग्री उम्र के साथ कम या ज्यादा नहीं बदलती है। लाइसोजाइम की गतिविधि में लगातार गिरावट आ रही है। अधिकतम 3 वर्षों तक वृद्धि की अवधि के बाद, उचित की सामग्री कम होने लगती है। छोटे बच्चों के लिए निरंकुश रक्षा तंत्र का बहुत महत्व है। हालांकि, अपर्याप्त एंटीजेनिक लोड के साथ वंशानुगत I. कारकों को जुटाने के लिए उनकी आरक्षित क्षमता अपर्याप्त रूप से व्यक्त की जाती है, जिसके परिणामस्वरूप उनकी कमी आसानी से होती है। एक बच्चे में I. के गठन की विशेषताएं मोटे तौर पर बच्चों में संक्रामक, भड़काऊ, एलर्जी और ऑटोइम्यून बीमारियों का कारण बनती हैं।
विशिष्ट और निरर्थक प्रतिरक्षा
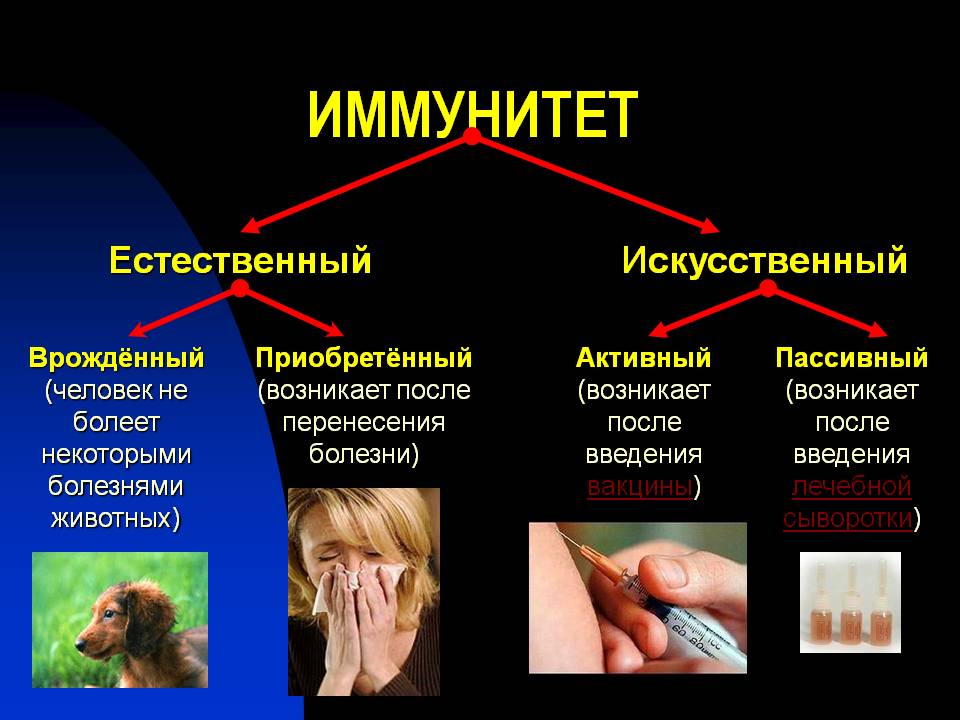
प्रतिरक्षण जन्मजात या अधिग्रहित हो सकता है। जन्मजात प्रतिरक्षा को गैर-विशिष्ट कहा जाता है। यह शरीर की जन्मजात जैविक विशेषताओं द्वारा प्रदान किया जाता है। जैसा कि आप जानते हैं, विभिन्न लोगों में एक ही बीमारी के लिए असमान प्रतिरोध होता है। अक्सर, यह किसी भी संक्रामक रोगों के लिए जन्मजात प्रतिरक्षा है जिसका अर्थ है "प्रतिरक्षा" शब्द।
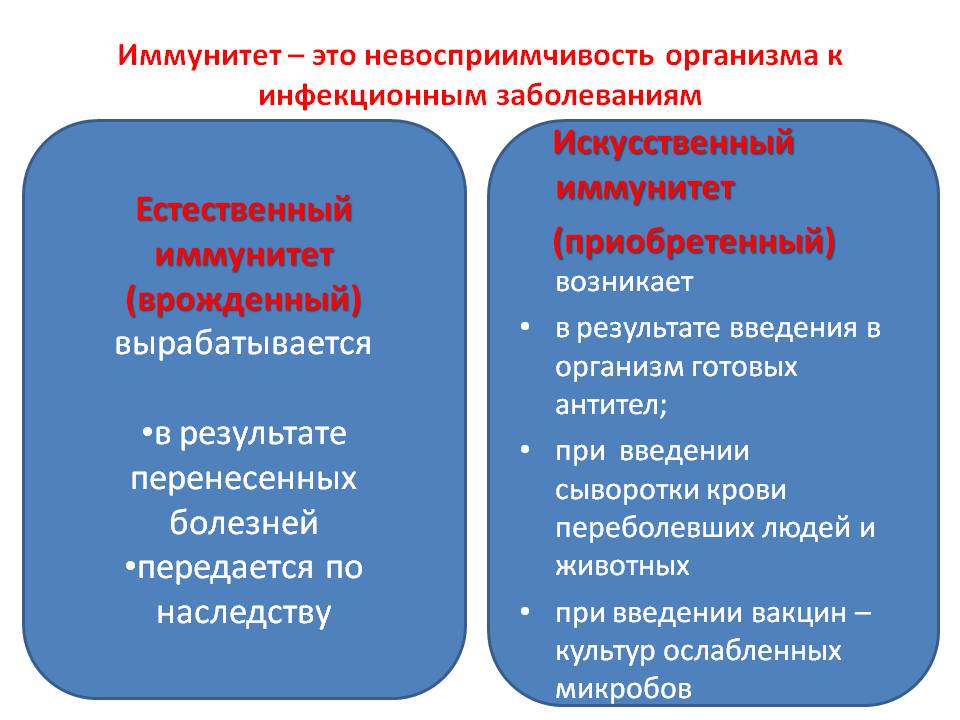
एक्वायर्ड इम्यूनिटी (विशिष्ट) कुछ संक्रामक रोगों के लिए शरीर की प्रतिरक्षा है। एक विशेष बीमारी के लिए एक्वायर्ड इम्युनिटी, जैसा कि इसके नाम से पता चलता है, जीवन भर हो सकती है। अधिग्रहित प्रतिरक्षा विरासत में नहीं मिली है।
सक्रिय और निष्क्रिय के बीच भेद, प्रतिरक्षा हासिल कर ली।सक्रिय प्रतिरक्षा एक पिछली बीमारी या सक्रिय टीकाकरण के बाद प्रकट होती है (टीकाकरण या टीका के परिणामस्वरूप: क्षीण वायरस या बैक्टीरिया की शुरूआत)। रोग के प्रेरक एजेंट के साथ टकराव के बाद, शरीर स्वयं इसे पहचानना शुरू कर देता है और स्वतंत्र रूप से एंटीबॉडी का उत्पादन करता है, जो संक्रमण से लड़ने के लिए मुख्य हथियार हैं।
निष्क्रिय प्रतिरक्षा शरीर में तैयार कृत्रिम रूप से तैयार एंटीबॉडी द्वारा प्रदान की जाती है। उदाहरण के लिए, निष्क्रिय प्रतिरक्षा तब होती है जब एंटी-डिप्थीरिया सीरम प्रशासित होता है या जब एंटीबॉडी स्तन के दूध के माध्यम से बच्चे के शरीर में प्रवेश करते हैं।
सक्रिय प्रतिरक्षा अधिक स्थायी, लंबी और अधिक विशिष्ट है (अर्थात, यह केवल एक विशिष्ट रोगज़नक़ से बचाता है)। कुछ रोगों में (उदाहरण के लिए, खसरा, स्कार्लेट ज्वर आदि), यह कई वर्षों तक बना रहता है, जबकि अन्य में (उदाहरण के लिए, चेचक) यह जीवन भर रहता है।
हमारे शरीर में प्रतिरक्षा रक्षा "संगठित" कैसे होती है?
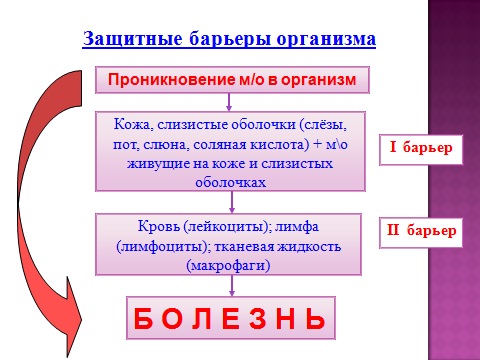
अधिकांश रोगाणुओं के लिए पहला अवरोध बरकरार त्वचा और श्लेष्म झिल्ली है, क्योंकि वे यांत्रिक सुरक्षा के अलावा, जीवाणुनाशक गुण हैं। त्वचा के सुरक्षात्मक गुण पसीने और वसामय ग्रंथियों के रहस्यों के कारण होते हैं। उदाहरण के लिए, टाइफाइड बुखार के प्रेरक एजेंट स्वस्थ मानव त्वचा के संपर्क के 15 मिनट बाद मर जाते हैं। श्लेष्म झिल्ली उन रहस्यों को गुप्त करती है जो रोगाणुओं के लिए और भी अधिक हानिकारक हैं।
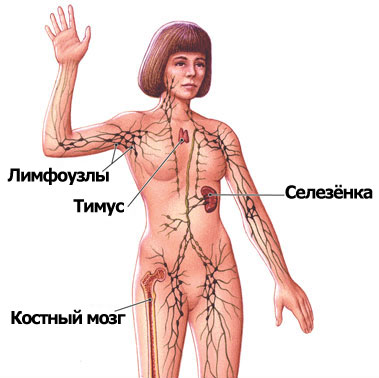
इन अंगों में, हमारे रक्षकों का गठन किया जाता है - एंटीबॉडी।
लेकिन रोगाणुओं के एक बड़े हमले के साथ या उनके उच्च रोगज़नक़ (रोग पैदा करने की क्षमता) के साथ, त्वचा और श्लेष्म बाधाएं पर्याप्त नहीं हैं, और रोगाणु शरीर में प्रवेश करते हैं। इस मामले में, सूजन होती है, सेलुलर और ह्यूमर इम्यूनिटी के जटिल तंत्र सक्रिय होते हैं: ल्यूकोसाइट्स और शरीर की अन्य कोशिकाएं काम के लिए ली जाती हैं, फागोसाइट्स प्रतिजन को पकड़ती हैं और पचा लेती हैं, विशेष पदार्थ जो विदेशी सूक्ष्मजीवों, जैसे कि इंटरफेरॉन, इम्युनोग्लोबुलिन और अन्य का मुकाबला करने के उद्देश्य से निर्मित होते हैं। शरीर की ये सभी प्रतिक्रियाएं निरर्थक प्रतिरक्षा की अभिव्यक्तियां हैं।
इसके साथ ही निस्पृह प्रतिरक्षा के साथ, एक विशिष्ट एक शामिल है। यह शरीर में एंटीबॉडी के गठन का कारण बनता है - विशेष रूप से एक विशिष्ट सूक्ष्म जीव के खिलाफ निर्देशित सुरक्षा कारक। लेकिन एंटीबॉडी उत्पादन की गति और प्रभावशीलता इस बात पर निर्भर करती है कि शरीर पहले इस बीमारी के प्रेरक एजेंट से मिला है या नहीं। यदि शरीर रोगज़नक़ को "पहचानता है" (अर्थात, यह पहले एक बीमारी या टीकाकरण का सामना कर चुका है), तो संक्रमण जल्दी से दबा दिया जाता है। यदि पहली बार इस तरह के सूक्ष्मजीव के साथ टकराव होता है, तो एंटीबॉडी के विकास में शरीर को यह सीखने में समय लगता है कि नए सूक्ष्म जीव से कैसे निपटा जाए।
प्रतिरक्षा कब घटती है?
मानव प्रतिरक्षा प्रणाली कमजोर है:
कुपोषण और कुपोषण, जिसमें विटामिन और आवश्यक खनिजों का अपर्याप्त सेवन शामिल है;
अधिक काम और पुराने तनाव;
एंटीबायोटिक्स और हार्मोनल ड्रग्स लेना;
वायुमंडलीय प्रदूषण, प्रतिकूल विकिरण की स्थिति।
इसके अलावा, चोटों, जलने, हाइपोथर्मिया, रक्त की कमी, संक्रमण और नशा, अक्सर सर्दी, पुरानी बीमारियों, मधुमेह सहित सर्जरी और संज्ञाहरण के साथ प्रतिरक्षा कम हो जाती है। प्रतिरक्षा में कमी मुख्य रूप से संक्रामक और विशेष रूप से जुकाम में प्रकट होती है, जैसे कि तीव्र श्वसन वायरल संक्रमण और इन्फ्लूएंजा।
अलग से कहने लायक बच्चों की प्रतिरक्षा के बारे में।बच्चे की वृद्धि की अवधि के दौरान, प्रतिरक्षा में कमी की गंभीर स्थिति उत्पन्न होती है। ऐसे पाँच काल हैं:
नवजात शिशु की अवधि (जीवन के पहले 29 दिन);
जीवन के 3 से 6 वें महीने तक;
जीवन का दूसरा वर्ष;
जीवन के 4 वें से 6 वें वर्ष तक;
किशोरावस्था।
बच्चों में प्रतिरोधक क्षमता में कमी बीमारियों की संख्या में वृद्धि को दर्शाती है। इसलिए, बाल रोग में, एक विशेष शब्द भी पेश किया जाता है “अक्सर बीमार बच्चे"(एफडब्ल्यूबी)। इस श्रेणी में वे बच्चे शामिल हैं जो साल में 4 बार बीमार होते हैं और कई बार या लगातार 2 सप्ताह से अधिक।
प्रतिरक्षा प्रणाली को मजबूत कैसे करें?
गैर-विशिष्ट और विशिष्ट प्रतिरक्षा दोनों पर अभिनय करके विभिन्न रोगों का सामना करने की शरीर की क्षमता को मजबूत करना संभव है। गैर-विशिष्ट प्रतिरक्षा को मजबूत करना शरीर के समग्र प्रतिरोध में वृद्धि है। एक नियम के रूप में, शब्द "प्रतिरक्षा को मजबूत करते हैं" का अर्थ है गैर-विशिष्ट प्रतिरक्षा का सामान्यीकरण।
प्रतिरक्षा प्रणाली को मजबूत करना चाहिए:
दैनिक दिनचर्या का निरीक्षण करें;
पूरी तरह से खाएं, सुनिश्चित करें कि आहार में पर्याप्त मात्रा में विटामिन, खनिज और पशु मूल के अमीनो एसिड होते हैं;
कड़ी मेहनत, खेल, या कम से कम नियमित रूप से व्यायाम में संलग्न;

एंटीऑक्सिडेंट और प्रतिरक्षा को मजबूत करने के लिए डिज़ाइन की गई अन्य दवाएं लें (उदाहरण के लिए, बीटा-कैरोटीन पर आधारित);
जब तक आपके डॉक्टर द्वारा सिफारिश न की जाए, एंटीबायोटिक लेने से बचें।
मजबूत या, एक विशेष बीमारी के खिलाफ एक विशिष्ट प्रतिरक्षा बनाएं केवल एक ही तरीका हो सकता है - टीका लगाना। हालांकि, यह ध्यान में रखा जाना चाहिए कि सक्रिय टीकाकरण के साथ (यानी, कमजोर रोगज़नक़ की शुरूआत के साथ), शरीर की प्रतिरक्षा का उद्देश्य एंटीबॉडी का उत्पादन करना है, जिसके परिणामस्वरूप अन्य बीमारियों का प्रतिरोध थोड़ा कम हो जाता है। इसलिए, टीकाकरण से पहले और बाद में, गैर-प्रतिरक्षा प्रतिरक्षा को मजबूत करना आवश्यक है।
टीकाकरण कैसे करें?
टीकाकरण एक विशिष्ट बीमारी से खुद को बचाने का एक विश्वसनीय तरीका है।। टीकाकरण के दौरान, एक कमजोर या मारे गए (निष्क्रिय) वायरस की शुरूआत के कारण सक्रिय प्रतिरक्षा का गठन होता है, जो स्वयं एक स्वस्थ व्यक्ति में बीमारी का कारण नहीं बन सकता है, लेकिन प्रतिरक्षा प्रणाली को "चालू करता है"।
यह याद रखना महत्वपूर्ण है कि कोई भी टीका विशिष्ट को बढ़ाने के लिए कुछ हद तक सामान्य प्रतिरक्षा को कमजोर करता है। नतीजतन, दुष्प्रभाव हो सकते हैं, उदाहरण के लिए, हल्के रूप में "फ्लू जैसी" लक्षणों की उपस्थिति (अस्वस्थता, सिरदर्द, थोड़ा ऊंचा तापमान)। बच्चों में, मुख्य समस्या टीकाकरण के बाद विभिन्न संक्रमणों या पृष्ठभूमि रोगों के विकास का है। बच्चों के संक्रमण के लिए अनुसंधान संस्थान के अनुसार, बच्चों में अक्सर टीकाकरण के बाद की अवधि की जटिलताएं विकसित होती हैं:
अक्सर बीमार (37.8%) की श्रेणी में आने वाले लोग;
एलर्जी प्रतिक्रियाओं (20.9%) के साथ;
केंद्रीय तंत्रिका तंत्र के घावों के साथ।
स्वस्थ बच्चों के विकास की संभावना अधिक होती है साइड इफेक्ट टीकाकरण के बाद 2.1% से अधिक नहीं है। वैक्सीन की शुरुआत से अवांछित प्रतिक्रियाओं से बचने के लिए, प्रतिरक्षा प्रणाली के कामकाज को सामान्य करने के लिए, अग्रिम में टीकाकरण के लिए शरीर को तैयार करना आवश्यक है। उदाहरण के लिए, बीटा कैरोटीन दवाएं एक अच्छा प्रभाव देती हैं। Vetoron।
बीटा-कैरोटीन-आधारित दवाओं को टीकाकरण से 1 महीने पहले शुरू किया जाना चाहिए और टीकाकरण के 1 महीने बाद तक जारी रखना चाहिए। यह सामान्य फ्लू शॉट के साथ, और नियमित टीकाकरण दोनों के साथ किया जाना चाहिए।
बीटा कैरोटीन प्रतिरक्षा प्रणाली को कैसे प्रभावित करता है?
बीटा-कैरोटीन का प्रतिरक्षा प्रणाली पर बहुमुखी प्रभाव पड़ता है, जैसे कि:
विटामिन ए का स्रोत;
प्रतिरक्षा उत्तेजक;
एंटीऑक्सीडेंट।
बीटा-कैरोटीन विटामिन ए का एक स्रोत है।
हमारे शरीर में बीटा-कैरोटीन विटामिन ए में परिवर्तित हो जाता है, जो प्रतिरक्षा प्रणाली के कामकाज में महत्वपूर्ण भूमिका निभाता है। विटामिन ए एंटीट्यूमर, एंटीवायरल सुरक्षा में शामिल है, ऑटोइम्यून और इम्यूनोडिफ़िशिएंसी राज्यों के लिए प्रतिरोध प्रदान करता है। विटामिन ए वायुमार्गों की रक्षा करने वाली सुरक्षात्मक कोशिकाओं के निर्माण के लिए भी जिम्मेदार है जठरांत्र संबंधी मार्ग और संक्रमण के लिए एक प्राकृतिक बाधा के रूप में कार्य करता है। कई वैज्ञानिकों के अनुसार, विटामिन ए प्रतिरक्षा के निर्माण में एक प्रमुख भूमिका निभाता है।
बीटा-कैरोटीन प्रतिरक्षा का एक उत्तेजक है।
बीटा-कैरोटीन खुद को "सच" इम्युनोमोड्यूलेटर के रूप में प्रकट करता है, अर्थात, यह रोगज़नक़ के प्रकार की परवाह किए बिना, शरीर की क्षमता को बढ़ाता है। बीटा-कैरोटीन सुरक्षात्मक प्रोटीन इंटरफेरॉन के संश्लेषण में शामिल है, जो प्रतिरक्षा प्रणाली की कोशिकाओं द्वारा निर्मित होता है और सक्रिय रूप से वायरस के प्रजनन को रोकता है। यह आपको शरीर की एंटीवायरल रक्षा में सुधार करने की अनुमति देता है।
इंटरफेरॉन उत्पादन रोग के एक लंबे पाठ्यक्रम (उदाहरण के लिए, अक्सर बीमार बच्चों में) के साथ कम हो जाता है, लेकिन बीटा-कैरोटीन इस पदार्थ के अतिरिक्त संश्लेषण को उत्तेजित कर सकता है और इस प्रकार शरीर की प्रतिरक्षा प्रणाली को मजबूत करता है।
बीटा कैरोटीन एक एंटीऑक्सिडेंट है।
बीटा-कैरोटीन मुक्त कणों को बेअसर करता है, जिसमें एक उच्च एंटीऑक्सिडेंट गतिविधि होती है। बीटा-कैरोटीन भी विटामिन ई को पुनर्स्थापित करता है, जो मुक्त कणों से लड़ते समय, अपने एंटीऑक्सीडेंट गुणों को खो देता है। इस प्रकार, बीटा-कैरोटीन विटामिन ई के माध्यम से प्रत्यक्ष और अप्रत्यक्ष रूप से प्रतिरक्षा को प्रभावित करता है।
अध्ययन RMAPO द्वारा संचालित, 4-6 वर्ष की आयु के 100 से अधिक बच्चे शामिल हैं। बच्चों में वैटरोन लेते समय:
बेहतर महसूस कर रहा है;
शारीरिक प्रदर्शन में वृद्धि;
भूख और नींद सामान्यीकृत;
गैर-विशिष्ट प्रतिरक्षा सुरक्षा में सुधार हुआ।
इसके अलावा, वेटोरन का उपयोग बच्चों को अक्सर बीमार होने की श्रेणी में आने से रोकता है - 94% मामलों में, प्रतिरक्षा में वृद्धि नोट की गई थी। पारिस्थितिक रूप से प्रतिकूल क्षेत्र के बच्चों के स्पा उपचार में वेटोरन के उपयोग ने शरीर के प्रतिरोध संकेतक (सेलुलर प्रतिरक्षा, आईजीजी एंटीबॉडी गठन और फागोसाइट्स की कार्यात्मक गतिविधि की सक्रियता) में सुधार करना संभव बना दिया। पारिस्थितिक रूप से प्रतिकूल क्षेत्रों में प्रदर्शन और अनुकूलन में सुधार करने के लिए, पूरे वर्ष दवा के निरंतर उपयोग की सिफारिश की जाती है।
अध्ययनों से पता चला है कि वैटोरोन लेने से प्रतिरक्षा प्रणाली मजबूत होती है, बच्चों को अक्सर बीमार होने की श्रेणी में आने से रोकता है, इन्फ्लूएंजा की घटना को लगभग 5 गुना कम कर देता है और लगभग किसी भी जटिलता को समाप्त कर देता है।
प्रयुक्त सामग्री edu.ru